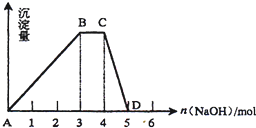
��Ŀ����
5��m1gNaOH��NaHCO3�Ĺ���������300���¼��ȳ�ַ�Ӧ���ų����������壬�õ�����m2g����$\frac{{m}_{2}}{{m}_{1}}$=a������˵����ȷ���ǣ�������| A�� | $\frac{53}{84}$��a��$\frac{53}{62}$ | |
| B�� | a=$\frac{53}{65}$ʱ��m2�й���ΪNa2CO3��NaOH | |
| C�� | a=$\frac{53}{75}$ʱ��m2�й���ΪNa2CO3 | |
| D�� | ��m1=58.4��m2=56.6����m1��NaHCO3Ϊ0.1mol |
���� A����ֻ��NaHCO3ʱ�����Ⱥ�ʣ�����������С����ֻ��NaOHʱ��ʣ�����������ݴ����ۼ���a��ȡֵ��Χ��
B���ȷ�����ӦΪ��NaHCO3+NaOH=Na2CO3 +H2O��������ǡ�÷�Ӧʱ��a=$\frac{106}{84+40}$=$\frac{53}{62}$���ݴ��ж�ʣ�������ɣ�
C������B�еķ��������жϣ�
D�������a�����B�ķ����жϷ�Ӧ����Ȼ������������ʵ�����ʽ���㣮
��� �⣺A����ֻ��NaHCO3ʱ�����Ⱥ�ʣ�����������С����2 NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2������֪a��$\frac{106}{168}$=$\frac{53}{84}$����ֻ��NaOHʱ��ʣ��������������a��1����$\frac{53}{84}$��a��1����A����
B���ȷ�����ӦΪ��NaHCO3+NaOH=Na2CO3 +H2O��������ǡ�÷�Ӧʱ����a=$\frac{106}{84+40}$=$\frac{53}{62}$����a=$\frac{53}{65}$��$\frac{53}{62}$��˵������������Ӧ��Ϻ�̼��������ʣ�̼࣬�����Ʒֽ⣬ʣ�����ijɷ�ΪNa2CO3����B����
C��a=$\frac{53}{75}$��$\frac{53}{62}$��˵��NaHCO3+NaOH=Na2CO3 +H2O��Ӧ��Ϻ�̼��������ʣ�̼࣬�����Ʒֽ⣬ʣ�����ijɷ�ΪNa2CO3����C��ȷ��
D����m1=58.4��m2=56.6����a=$\frac{56.6}{58.4}$��$\frac{53}{62}$��˵����Ӧ��NaOH������������ӦΪNaHCO3+NaOH=Na2CO3 +H2O������ǡ�ù���������Ϊ����ˮ�����ʵ�������n��H2O��=$\frac{58.4g-56.6g}{18g/mol}$=0.1mol����Ϸ�Ӧ��֪��ԭ�������̼�����Ƶ����ʵ���Ϊ0.1mol����m1��NaHCO3Ϊ0.1mol����D��ȷ��
��ѡCD��
���� ���⿼�����ﷴӦ�ļ��㣬��Ŀ�ѶȽϴ��ؿ���ѧ������˼ά�����Ŀ��飬ע�⼫�����ֶη���Ӧ�ã�����������ѧ���ķ�����������ѧ����������

| A�� | CH3CH3 | B�� | CH2=CHCl | C�� | CH3CH2OH | D�� | CH3COOCH2CH3 |
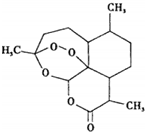 2015��ŵ��������ѧ��ҽѧ�������й�ҩѧ���������Լ���������ѧ������•���������ձ���ѧ�Ҵ���ǣ����������ڼ����漲�������о�����ȡ�õijɾͣ������������Եط����������أ�������ű�������·�����ͼΪ�����أ����ڸ����ʵ�����˵����ȷ���ǣ�������
2015��ŵ��������ѧ��ҽѧ�������й�ҩѧ���������Լ���������ѧ������•���������ձ���ѧ�Ҵ���ǣ����������ڼ����漲�������о�����ȡ�õijɾͣ������������Եط����������أ�������ű�������·�����ͼΪ�����أ����ڸ����ʵ�����˵����ȷ���ǣ�������| A�� | �����ػ�ѧʽΪC15H20O5 | B�� | �ڹ��������¿��ܷ���ȡ����Ӧ | ||
| C�� | ���������������ӳɷ�Ӧ | D�� | ˮ�����������ű�������õ���Ч |
 ���Ƿ���ʹ����KMnO4��Һ��ɫ�����Ƚ�����ϩ�����ʵ����ܼ�����������������KMnO4��Һ��������ʵ�������ʺ������ܽ��ϩ���Լ��ǣ�������
���Ƿ���ʹ����KMnO4��Һ��ɫ�����Ƚ�����ϩ�����ʵ����ܼ�����������������KMnO4��Һ��������ʵ�������ʺ������ܽ��ϩ���Լ��ǣ�������| A�� | ���Ȼ�̼ | B�� | �ƾ� | C�� | �ױ� | D�� | ˮ |
| A�� | ���ǰ������Һ��ˮ�ĵ���̶ȴ� | |
| B�� | ���ǰc��CH3COOH������c��Na+�� | |
| C�� | ��Ϻ���c��Na+��=c��CH3COO-��������ǰ��������� | |
| D�� | �ֱ�ϡ��10��������Һ��pH֮�ʹ���14 |
| A�� |  ��ͼ��������к�����ϩ | B�� |  ��ͼ��ȥCO�л��е�����CO2 | ||
| C�� |  ��ͼ��֤��ѹ����ԭ�� | D�� |  ��ͼ�ռ�NH3 |
| A�� | ���������Ϊ86 | B�� | ������Ϊ86 | C�� | ������Ϊ136 | D�� | �˵����Ϊ222 |
| A�� | ��ϡNa0H��Һ��ȥ���������е����� | |
| B�� | һ�������¿�����H2��ȥ�����л��е���ϩ | |
| C�� | ����ʱ�¶ȼƵ�ˮ����Ӧ����Һ��֮�� | |
| D�� | ����к͵ζ�ʵ���У���ƿ������ˮϴ�Ӻ���ע�����Һ |