题目内容
在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,改变某一条件,下列说法错误的是( )
| A、升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B、增大压强,可提高CO2转化率 |
| C、增加CO2的浓度,可提高H2转化率 |
| D、改用高效催化剂,反应的平衡常数不变 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.升高温度,正、逆反应速率都增大;
B.增大压强,平衡正向移动,可提高CO2转化率;
C.增大CO2的浓度,平衡向正反应方向移动,其它反应物的转化率升高;
D.平衡常数只受温度影响.
B.增大压强,平衡正向移动,可提高CO2转化率;
C.增大CO2的浓度,平衡向正反应方向移动,其它反应物的转化率升高;
D.平衡常数只受温度影响.
解答:
解:A.正反应为放热反应,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,故A错误;
B.增大压强,平衡正向移动,可提高CO2转化率,故B正确;
C.增大CO2的浓度,平衡向正反应方向移动,可提高H2转化率,故C正确;
D.平衡常数只受温度影响,使用催化剂不影响平衡常数,故D正确,
故选A.
B.增大压强,平衡正向移动,可提高CO2转化率,故B正确;
C.增大CO2的浓度,平衡向正反应方向移动,可提高H2转化率,故C正确;
D.平衡常数只受温度影响,使用催化剂不影响平衡常数,故D正确,
故选A.
点评:本题考查化学平衡、反应速率及平衡常数的影响因素,难度不大,注意根据平衡移动原理分析解答.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol[Ag (NH3)2]OH配合物中含有9NA个σ键 |
| B、标准状况下,22.4L C2H6O中含C-H键5NA |
| C、1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA |
| D、KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,生成71g Cl2时,转移的电子数目为2NA |
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol?L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
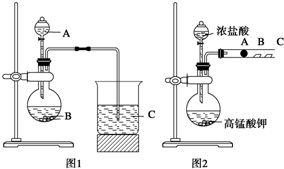 某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究; 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.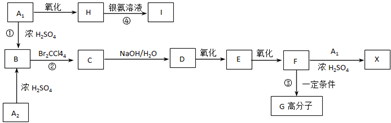
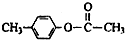 、
、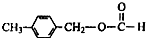 外,其余的结构简式:
外,其余的结构简式: