题目内容
元素周期表的形式多种多样,有一类周期表是利用每个位置凸起的高低来表示元素的某种性质的强弱或数值标度的大小,两者成正比关系.下图是这类周期表的局部区域的三种不同情况.请判断: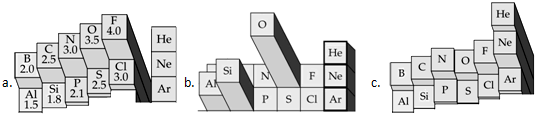
(1)表示元素的得电子能力高低的是 ;
(2)表示元素在地壳中丰度的是 ;
(3)16O和18O是氧元素的两种核素,下列说法正确的是 .
①16O2与18O2互为同素异形体 ②16O与18O核外电子排布相同 ③通过化学变化可以实现16O与18O间的相互转化.

(1)表示元素的得电子能力高低的是
(2)表示元素在地壳中丰度的是
(3)16O和18O是氧元素的两种核素,下列说法正确的是
①16O2与18O2互为同素异形体 ②16O与18O核外电子排布相同 ③通过化学变化可以实现16O与18O间的相互转化.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)根据元素周期律可知元素的得电子能力在周期表中从左向右依次增强;
(2)地壳中今量最多的非金属元素是氧,其次是硅.最多的金属元素是铝;
(3)16O和18O是互为同位素的两个原子,它们形成的单质不是互为同素异形体而是同一种物质(从化学性质的角度看),它们的核外电子排布相同,所以它们形成的单质的化学性质相同,16O与18O间的相互转化是原子核中的中子数发生改变,这是核反应,不是化学变化.
(2)地壳中今量最多的非金属元素是氧,其次是硅.最多的金属元素是铝;
(3)16O和18O是互为同位素的两个原子,它们形成的单质不是互为同素异形体而是同一种物质(从化学性质的角度看),它们的核外电子排布相同,所以它们形成的单质的化学性质相同,16O与18O间的相互转化是原子核中的中子数发生改变,这是核反应,不是化学变化.
解答:
解:(1)根据元素周期律可知元素的得电子能力在周期表中从左向右依次增强,而图a凸起的位置正好符合这个特征,故答案为:a;
(2)地壳中今量最多的非金属元素是氧,其次是硅.最多的金属元素是铝;而图b凸起的位置正好符合这个特征,故答案为:b;
(3)16O和18O是互为同位素的两个原子,它们形成的单质不是互为同素异形体而是同一种物质(从化学性质的角度看),它们的核外电子排布相同,所以它们形成的单质的化学性质相同,16O与18O间的相互转化是原子核中的中子数发生改变,这是核反应,不是化学变化,故答案为:②.
(2)地壳中今量最多的非金属元素是氧,其次是硅.最多的金属元素是铝;而图b凸起的位置正好符合这个特征,故答案为:b;
(3)16O和18O是互为同位素的两个原子,它们形成的单质不是互为同素异形体而是同一种物质(从化学性质的角度看),它们的核外电子排布相同,所以它们形成的单质的化学性质相同,16O与18O间的相互转化是原子核中的中子数发生改变,这是核反应,不是化学变化,故答案为:②.
点评:本题考查了学生对同位素、同素异形体、以及化学变化等基本概念的把握和元素周期律及周期表的理解等基本内容,对学生的能力要求较低,是一道基础题.

练习册系列答案
相关题目
已知KH跟水反应的方程式为:KH+H2O→KOH+H2↑,下列有关KH的叙述错误的是( )
| A、KH中H是-1价 |
| B、该反应转移的电子数为2个 |
| C、H2是氧化产物,也是还原产物 |
| D、KH可以在野外生存时做应急生氢药品 |
在一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为4.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
| A、17% | B、25% |
| C、33% | D、50% |
下列离子方程式正确的是( )
| A、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O |
| D、向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |