题目内容
15.火药是中国的“四大发明”之一,是炎黄子孙的骄傲,也会永远激励着我们去奋发图强.黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S═K2S+2NO2↑+CO2↑.其中还原剂是C.分析 2KNO3+C+S═K2S+2NO2↑+CO2↑中,C元素的化合价升高,N、S元素的化合价降低,以此来解答.
解答 解:2KNO3+C+S═K2S+2NO2↑+CO2↑中,N、S元素的化合价降低,被还原,则氧化剂为KNO3、S;C元素的化合价升高被氧化,则C为还原剂,
故答案为:C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中还原剂、氧化剂判断的考查,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
6.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | KCl | B. | NaOH | C. | CuSO4 | D. | Na2SO4 |
10.现有几种元素的性质或原子结构如下表:
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是${\;}_6^{12}$C.
(2)画出T的离子结构示意图 .
.
(3)写出实验室制取Y单质的化学方程式2KMnO4$\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)Z的三种同位素原子名称氕、氘、氚.
(5)写出由T、X和Y三种元素组成的一种化合物在水溶液中的电离方程式NaClO=Na++ClO-.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 阳离子就是一个质子 |
(2)画出T的离子结构示意图
 .
.(3)写出实验室制取Y单质的化学方程式2KMnO4$\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)Z的三种同位素原子名称氕、氘、氚.
(5)写出由T、X和Y三种元素组成的一种化合物在水溶液中的电离方程式NaClO=Na++ClO-.
20.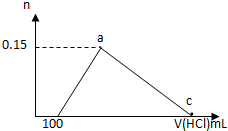 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )| A. | 原AlCl3溶液的物质的量浓度为1.5mol/L | |
| B. | c点的体积为750mL | |
| C. | 原加入的NaOH的物质的量为0.7mol | |
| D. | a和c点间铝元素以AlO2-和Al(OH)3的形式存在 |
5.如图是a、b两种固体物质(不含结晶水)的溶解度曲线.下列说法正确的是( )
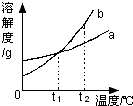

| A. | b的溶解度大于a的溶解度 | |
| B. | t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等 | |
| C. | 将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液 | |
| D. | t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 |
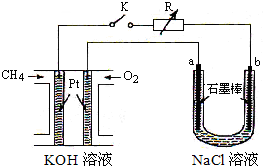 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示. .
.


