题目内容
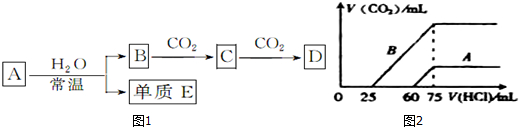
8.已知2SO3(g)?2SO2(g)+O2(g)△H>0,现将2mol SO3充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A、气体密度是个变量,所以可以用来衡量该反应是否达到平衡状态;
B、该反应的反应热是定值;
C、随着反应的进行,SO3分解速率逐渐降低;
D、SO3转化率在平衡前逐渐增大.
解答 解:A、由于恒压密闭容器中,容器的容积随着气体的物质的量变化而变化,气体的质量和容器体积不再变化时,密度不变,说明各组分的物质的量不再变化,正逆反应速率相等,达到了平衡状态,故A正确;
B、该反应的反应热是定值,不能作为判断是否达到平衡状态的依据,故B错误;
C、随着反应的进行,SO3分解速率逐渐降低,故C错误;
D、SO3转化率在平衡前是逐渐增大的,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,注意对图象的正确分析,题目难度不大,注意知识的迁移应用是关键.

练习册系列答案
相关题目
19.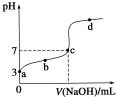 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
16.W、X、Y、Z是原子序数依次增大的同一短周期的主族元素.W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y.下列说法正确的是( )
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
3.实验室合成环己酮的反应、装置示意图及有关数据如下:
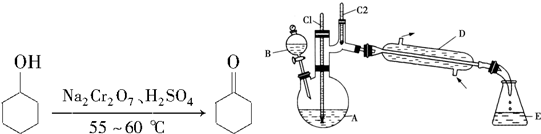
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表
注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点.
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中通过装置B将酸性Na2Cr2O7溶液(查资料可知Cr是重金属元素,具有致癌性)加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①如何滴加酸性Na2Cr2O7溶液打开分液漏斗上边的玻璃塞,(或含有铬元素的物质)拧开下边的活塞,缓慢滴加,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有致癌危险的Na2Cr2O7(或避免使用含有致癌性铬元素的物质).
②蒸馏不能分离环己酮和水的原因是环己酮和水形成具有固定组成的恒沸物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 4 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.947 8 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 1 | |
| 水 | 100.0 | 0.998 2 |
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中通过装置B将酸性Na2Cr2O7溶液(查资料可知Cr是重金属元素,具有致癌性)加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①如何滴加酸性Na2Cr2O7溶液打开分液漏斗上边的玻璃塞,(或含有铬元素的物质)拧开下边的活塞,缓慢滴加,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有致癌危险的Na2Cr2O7(或避免使用含有致癌性铬元素的物质).
②蒸馏不能分离环己酮和水的原因是环己酮和水形成具有固定组成的恒沸物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
5.下列反应的离子方程式不正确的是( )
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
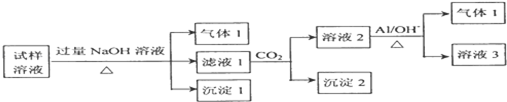
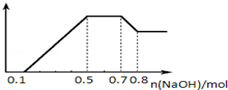
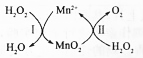 MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:
MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题: