题目内容
16.减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一.(1)己知:N2 (g)+O2 (g)=2NO (g)△H=+180.5kJ•mol-1
C(s)+O2 (g)=CO2 (g)△H=-393.5kJ•mol-1
2C (s)+O2(g)=2CO (g)△H=-221kJ•mol-1
若某反应的平衡常数表达式为:$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,
请写出此反应的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol-1.
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为2NO2+8e-=N2+4O2-.
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) $\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g) 己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是①③④(填序号).

①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系.

回答下列问题:
①温度:T1> T2(填“<”或“>”).
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=0.22 L•mol-1(结果精确到两位小数);用CO的浓度变化表示的平均反应速率V(CO)=0.1 mol/(L•min).
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的A点.
分析 (1)依据平衡常数表达式书写热化学方程式,结合已知的热化学方程式和盖斯定律计算得到缩小热化学方程式的焓变,得到此反应的热化学方程式;
(2)若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,负极为甲烷失电子生成二氧化碳,正极二氧化氮得到电子生成氮气,用氧离子配平电荷守恒得到电极反应;
(3)①温度升高化学反应速率加快,催化剂的催化效率降低;
②反应是放热反应,温度升高平衡逆向进行;
③该反应是放热反应,升温平衡逆向移动;
④温度越低催化剂活性越小,反应速率越慢;
(4)①根据反应2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大;
②化学平衡三行计算列式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;用CO的浓度变化表示的平均反应速率v(CO)=$\frac{△c}{△t}$;
③根据三行式结合化学平衡移动原理来回答.
解答 解:(1)若某反应的平衡常数表达式为:k=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),
①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
②C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
③2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
盖斯定律计算②×2-③-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•molˉ1,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1;
(2)若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,负极为甲烷失电子生成二氧化碳,正极二氧化氮得到电子生成氮气,用氧离子配平电荷守恒得到电极反应,正极电极反应为:2NO2+8e-=N2+4O2-,
故答案为:2NO2+8e-=N2+4O2-;
(3)①温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不最大,故①错误;
②升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故②正确;
③温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故③错误;
④为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故④错误;
故答案为:①③④;
(4)①根据反应2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746kJ•mol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2,
故答案为:>;
②某温度下,反应达到平衡状态D点时,NO的体积分数是25%,设CO的变化浓度是x,
2CO(g)+2NO(g)?N2(g)+2CO2(g)
初始浓度:2.5 2 0 0
变化浓度:x x 0.5x x
平衡浓度:2.5-x 2-x 0.5x x
NO的体积分数是25%,即$\frac{2-x}{2.5-x+2-x+0.5x+x}$×100%=25%,解得x=1,此时K=$\frac{{1}^{2}×0.5}{1.{5}^{2}×1}$=0.22 L•mol-1;
用CO的浓度变化表示的平均反应速率V(CO)=$\frac{1mol/L}{10min}$=0.1 mol•L-1•min-1,
故答案为:0.22 L•mol-1;0.1 mol/(L•min);
③若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,
故答案为:A.
点评 本题涉及盖斯定律的应用、化学平衡的有关计算,电极反应式的书写知识,注意知识的综合应用是关键,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案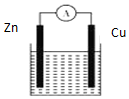
| A. | 产生1 g H2,消耗锌的质量65 g | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置不可实现化学能全部转化为电能 | |
| D. | 铜做正极发生还原反应 |
| A. | Z、W单质的熔点:Z>W | |
| B. | 最高价氧化物对应的水化物的酸性:Y>W | |
| C. | 四种元素的原子半径:X>Y>Z>W | |
| D. | Z元素处于元素周期表中第三周期第ⅡA族 |
 工业上“固定”和利用CO2能有效地减轻“温室效应”.
工业上“固定”和利用CO2能有效地减轻“温室效应”.I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,某科学实验将6molCO2和8molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):
回答下列问题:
(1)该反应在B条件下能自发进行(城编号).
A.高温 B.低温 C.任何温度
(2)该反应在0~8min内CO2的平均反应速率是0.125mol/(L•min).
(3)该反应的平街常数K=0.5(L/mol)2.
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,虚线I改变的条件可能是升高温度.若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是KK=K2>K1.
II.己知25℃时,乙酸和碳酸的电离平衡常数如2表:
| 物质的化学式 | CH3COOH | HCO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
( 2 ) 25℃时,在0.lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;该混合溶液中的两种浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
①HC1比H2S稳定
②S2-还原性比C1-强
③C12能与H2S反应生成S
④HC1的溶解度比 H2S大
⑤相同条件下C12与Fe反应生成FeCl3,S与Fe生成FeS
⑥HC1的酸性比H2S强.
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
 常温下,向 1L 0.10mol•L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是( )
常温下,向 1L 0.10mol•L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是( )| A. | 溶液的pH比较:x<y<z | |
| B. | 在y点再通入0.05 mol HCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COOH的Ka=104.75 |
 W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界.
W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界. .
. ,与B的离子具有相同电子数的微粒中,有两种分子可化合生成一种盐,该盐易潮解,受热或遇热水可分解,能腐蚀玻璃,两分子反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有两种分子可化合生成一种盐,该盐易潮解,受热或遇热水可分解,能腐蚀玻璃,两分子反应的化学方程式是NH3+HCl═NH4Cl; .
.