题目内容
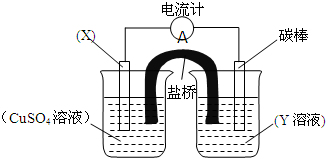 依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:(1)电极X的材料是
(2)碳电极为电池的
(3)外电路中的电流是从
(4)肼(N2H4,常温下液态)与空气组成的燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为(反应生成无污染物质)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据方程式,失电子的物质作负极;电解质是反应物中可溶性的、得电子的物质;
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;
(3)外电路中的电流是从正极流向负极;根据电极反应式计算;
(4)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2.
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;
(3)外电路中的电流是从正极流向负极;根据电极反应式计算;
(4)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2.
解答:
解:(1)原电池中失电子的物质作负极,根据方程式知,铜铜失电子作负极,导电的非金属碳棒作正极;电解质是反应物中可溶性的、得电子的物质,所以电解质是可溶性的铁盐,可用Fe2(SO4)3作电解质;
故答案为:Cu;Fe2(SO4)3;
(2)碳棒作正极,正极上得电子,发生还原反应,根据方程式知,Fe3+得电子,生成Fe2+,正极反应为2Fe3++2e-=2Fe2+,
故答案为:正;2Fe3++2e-=2Fe2+;
(3)外电路中的电流是从正极流向负极,即电流从碳棒流向Cu;Cu电极的电极反应为Cu-2e-=Cu2+,当Cu电极的质量减小了3.2g时,参加反应Cu的物质的量为
=0.05mol,所以流经电流计的电子的物质的量为0.1mol.
故答案为:碳棒;Cu;0.1mol;
(4)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,
故答案为:N2H4+4OH--4e-=N2+4H2O.
故答案为:Cu;Fe2(SO4)3;
(2)碳棒作正极,正极上得电子,发生还原反应,根据方程式知,Fe3+得电子,生成Fe2+,正极反应为2Fe3++2e-=2Fe2+,
故答案为:正;2Fe3++2e-=2Fe2+;
(3)外电路中的电流是从正极流向负极,即电流从碳棒流向Cu;Cu电极的电极反应为Cu-2e-=Cu2+,当Cu电极的质量减小了3.2g时,参加反应Cu的物质的量为
| 3.2g |
| 64g/mol |
故答案为:碳棒;Cu;0.1mol;
(4)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,
故答案为:N2H4+4OH--4e-=N2+4H2O.
点评:本题考查原电池和电解池的工作原理,做题时注意两极上的变化,要会书写电极反应式,从质量守恒和电子守恒的角度做题,题目难度中等.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、小苏打溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
| B、石灰水与足量的碳酸氢钾溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、大理石跟醋酸溶液反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
| D、过氧化钠与水的反应:2O22-+2H2O═4OH-+O2↑ |
下列实验操作正确的是( )
A、 点燃酒精灯 |
B、 沉淀的过滤 |
C、 石油的分馏 |
D、 NaCl固体的称量 |