题目内容
12.下列说法中,不正确的是( )| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. | 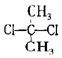 与 与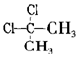 互为同分异构体 互为同分异构体 |
分析 A.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷;
B.溴水具有氧化性,醛基具有还原性;
C.乙烯与溴发生加成反应,使溴水中水层褪色;苯萃取溴水的溴,使溴水中水层褪色;
D.甲烷是正四面体结构.
解答 解:A.1mol乙烯与Cl2完全加成,消耗氯气1mol,生成1mol1,2-二氯乙烷,1mol1,2-二氯乙烷与4molCl2发生取代反应,生成1mol六氯乙烷,故共消耗氯气5mol,故A正确;
B.溴水具有氧化性,醛基具有还原性,溴水能与乙醛发生氧化还原反应,使溴水褪色,故B正确;
C.乙烯与溴发生加成反应,使溴水中水层褪色,溴在苯的溶解度远远大于水中的溶解度,苯萃取溴水的溴,使溴水中水层褪色,二者褪色原理不同,故C正确;
D.甲烷是正四面体结构,故 与
与 为同一物质,故D错误,
为同一物质,故D错误,
故选D.
点评 本题考查有机物的结构和性质,为高频考点,涉及乙烯、苯、醛基的性质以及甲烷的结构,难度不大,注意甲烷是正四面体结构.

练习册系列答案
相关题目
3.CaCO3的摩尔质量为100g/mol,将5.0g CaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Ca2+的物质的量浓度为( )
| A. | 5.0 mol/L | B. | 0.50 mol/L | C. | 1.0 mol/L | D. | 0.10 mol/L |
20.下列说法正确的是( )
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,通常放出大量热 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
7.下列关于电解质的电离平衡状态的叙述中,正确的是( )
| A. | 弱电解质的电离达到平衡状态后,电离就停止了 | |
| B. | 弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等 | |
| C. | 弱电解质的电离达到平衡状态后,分子和离子的浓度相等 | |
| D. | 弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动 |
17.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为0 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
4.化学在生产和日常生活中有着重要的应用.下列说法中不正确的是( )
| A. | 电解AlCl3饱和溶液,可制得金属铝 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
1.下列说法不正确的是( )
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 纯银在空气中久置变黑发生的是化学腐蚀 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |