题目内容
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈
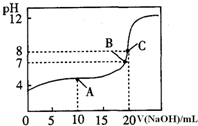
(4)25℃,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图.
①为减小实验误差,由图可知滴定时指示剂应选用
②A、B、C三点所示溶液导电能力最强的是
③25℃,HA的电离平衡常数约为
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)CH3COONa溶液呈碱性是因为水解呈碱性,加水稀释不仅显性离子氢氧根离子浓度减小,但水解平衡正向移动,如果平衡不移动,PH减小两个单位,但因平衡正向移动,所以减少不到两个单位;不考虑水分蒸发,NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大;
(2)从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制;
(3)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成NaAc,醋酸根离子水解显碱性,根据电荷守恒比较离子浓度的大小;pH=1的醋酸和pH=13的氢氧化钠溶液,醋酸浓度较大,等体积混合时,醋酸过量;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂,离子浓度越大导电能力越强,根据曲线数据利用C(H+),结合HA?H++A-求出已电HA的浓度,再根据电离平衡常数表达式来解答.
(2)从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制;
(3)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成NaAc,醋酸根离子水解显碱性,根据电荷守恒比较离子浓度的大小;pH=1的醋酸和pH=13的氢氧化钠溶液,醋酸浓度较大,等体积混合时,醋酸过量;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂,离子浓度越大导电能力越强,根据曲线数据利用C(H+),结合HA?H++A-求出已电HA的浓度,再根据电离平衡常数表达式来解答.
解答:
解:(1)CH3COONa溶液呈碱性是因为水解呈碱性,加水稀释不仅显性离子氢氧根离子浓度减小,但水解平衡正向移动,如果平衡不移动,PH减小两个单位,但因平衡正向移动,所以减少不到两个单位,所以PH>11,原因是:加水稀释使平衡CH3COO-+H2O CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O
CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O CH3COOH+OH-,右移;>;
CH3COOH+OH-,右移;>;
(2)中相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,故答案为:①=②>③;
(3)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成NaAc,由化学式可知,阴阳离子之比为1:1,醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-),醋酸为弱电解质,pH=1的醋酸和pH=13的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(CH3COO-),故答案为:碱;>;酸;<;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点是离子浓度最大导电能力最强,当加氢氧化钠的体积为0时,
c(H+)=10-3mol/L,K=
=
=5×10ˉ4,故答案为:①酚酞; ②C; ③5×10ˉ4.
 CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O
CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O CH3COOH+OH-,右移;>;
CH3COOH+OH-,右移;>;(2)中相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,故答案为:①=②>③;
(3)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成NaAc,由化学式可知,阴阳离子之比为1:1,醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-),醋酸为弱电解质,pH=1的醋酸和pH=13的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(CH3COO-),故答案为:碱;>;酸;<;
(4)由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点是离子浓度最大导电能力最强,当加氢氧化钠的体积为0时,
c(H+)=10-3mol/L,K=
| C(H+)?C(A-) |
| C(HA) |
| 10-3×10-3 |
| 0.1-10-3 |
点评:本题考查酸碱混合以及溶液pH的大小比较,为高考常见题型,题目难度中等,本题注意从溶液电中性的角度比较溶液离子浓度的大小关系,另外把握盐类水解的原理.

练习册系列答案
相关题目
下列分子或离子在指定的溶液中一定能大量存在的是( )
| A、常温下呈中性的溶液:Fe3+、Na+、Cl-、SO42- |
| B、1mol/L的NaAlO2溶液:NH3?H2O、CO32-、K+、SiO32- |
| C、与铝单质反应产生氢气的溶液:Na+、K+、NO3-、Mg2+ |
| D、由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+ |
已知C(石墨,s)═C(金刚石,s)△H>0,P(白磷,s)═P(红磷,s)△H<0.根据上述信息推论正确的是( )
| A、前者为放热反应 |
| B、红磷的能量比白磷低 |
| C、金刚石比石墨稳定 |
| D、上述变化都为物理变化 |
 有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.