题目内容
下列化学用语正确的是( )
A、NH4H的电子式: |
| B、硬脂酸的分子式为:C17H35COOH |
C、基态Mg原子的核外电子轨道表示式: |
| D、Cr元素的外围电子排布式:3d54S1 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.NH4H为离子化合物,漏掉了氢离子最外层含有的2个电子;
B.分子式中不需要标出官能团,C17H35COOH为硬脂酸的结构简式;
C.3s轨道的电子的自旋方向应该相反;
D.根据构造原理及铬元素的核电荷数形成其外围电子排布式.
B.分子式中不需要标出官能团,C17H35COOH为硬脂酸的结构简式;
C.3s轨道的电子的自旋方向应该相反;
D.根据构造原理及铬元素的核电荷数形成其外围电子排布式.
解答:
解:A.NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为 ,故A错误;
,故A错误;
B.硬脂酸分子中含有18个C,为饱和一元羧酸,硬脂酸的分子式为:C18H36O2,故B错误;
C.镁为12号元素,3s轨道的两个电子的自旋方向错误,基态Mg原子正确的核外电子轨道表示式为: ,故C错误;
,故C错误;
D.Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,则其外围电子排布式为:3d54S1,故D正确;
故选D.
 ,故A错误;
,故A错误;B.硬脂酸分子中含有18个C,为饱和一元羧酸,硬脂酸的分子式为:C18H36O2,故B错误;
C.镁为12号元素,3s轨道的两个电子的自旋方向错误,基态Mg原子正确的核外电子轨道表示式为:
 ,故C错误;
,故C错误;D.Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,则其外围电子排布式为:3d54S1,故D正确;
故选D.
点评:本题考查了电子式、核外电子排布式、分子式等表示方法及判断,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确核外电子排布式的表示方法.

练习册系列答案
相关题目
酸和醇反应生成的酯的相对分子质量为90,该反应的反应物是( )
A、 和CH3CH2OH 和CH3CH2OH |
B、 和CH3CH218OH 和CH3CH218OH |
C、 和CH3CH218OH 和CH3CH218OH |
D、 和CH3CH2OH 和CH3CH2OH |
乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说明不正确的是( )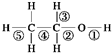

| A、乙醇和钠反应,键①断裂 |
| B、在Ag催化下和O2反应,键①③断裂 |
| C、乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂 |
| D、乙醇完全燃烧时断裂键①② |
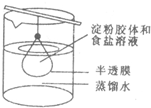 将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A、用激光笔照射该烧杯中的液体,会产生丁达尔现象 |
| B、烧杯内液体加入碘水后呈蓝色 |
| C、该淀粉胶体在催化剂作用下可水解生成葡萄糖和果糖 |
| D、将烧杯中液体蒸干,得到的固体物质可用来制取纯碱 |
观察下列模型并结合有关信息,判断有关说法正确的是( )
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  |
 |
 |
 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A、单质硼属分子晶体,其结构单元B12中含有30个B-B键,含20个正三角形 |
| B、SF6是由极性键构成的分子 |
| C、固态硫S8属于原子晶体 |
| D、NaCl熔化和溶于水均能产生自由移动的离子,且破坏的是同种作用力,NaCl晶胞中每个Na+周围最近且等距离的Na+有6个 |
化学与生产和生活密切相关,下列说法正确的是( )
| A、金属钠可以保存在煤油或酒精中,防止在空气中变质 |
| B、石油的裂化和煤的干馏,都属于化学变化 |
| C、等质量的葡萄糖和果糖在人体内完全氧化释放的能量相等 |
| D、聚氯乙烯制品易造成白色污染,可采用焚烧法处理 |
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如图所示: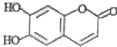 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A、该物质在酸性条件下加热可以水解 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1mol M与足量NaHCO3反应能生成2mol CO2 |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是( )
| A、a原子的最外层电子数比B原子的最外层电子数少 |
| B、a原子电子层数比b原子的电子层数多 |
| C、1mol a从酸中置换H+生成的H2比b从酸中置换H+生成的H2要容易 |
| D、常温时,b能从水中置换出氢,而a不能 |