题目内容
1.用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体,实验方案如下: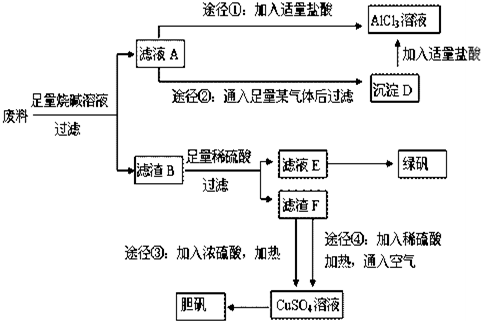
(1)写出废料与烧碱溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为较合理的途径及理由是::②合理,途径②制得的氯化铝溶液纯度高;途径①制取的AlCl3溶液中混有NaCl杂质.
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还可能存在Fe3+.
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点产生等量胆矾途径④消耗硫酸少、途径④不会产生污染大气的气体.
(5)途径④发生反应的化学方程式为:2Cu+2H2SO4+O2═2CuSO4+2H2O.
分析 只含有铝、铁、铜的工业废料加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液E为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,途径③用铜与浓硫酸反应生成硫酸铜,途径④用稀硫酸与空气氧化铜生成硫酸铜,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径①生成氯化铝溶液,而滤液A通足量气体C经途径②生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以途径②中的气体为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液,
(1)根据铝与碱反应生成偏铝酸钠和氢气;
(2)根据物质的性质结合框图转化关系和所得产品进行解答;
(3)二价铁易被空气中的氧气氧化成三价铁离子;
(4)从环保和原料的利用率角度解答;
(5)铜和氧气和酸反应生成硫酸铜和水;
解答 解:(1)因铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)途径①发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O,会引入盐酸,氯化钠杂质;
故答案为:②合理,途径②制得的氯化铝溶液纯度高;途径①制取的AlCl3溶液中混有NaCl杂质;
(3)滤液E的成分中的二价铁离子易被空气中的氧气氧化成三价铁离子,
故答案为:Fe3+;
(4)途径③的反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,途径④的反应:2Cu+O2+2H2SO4(稀)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,从反应方程式看出产生等量胆矾途径④消耗硫酸少,途径④不会产生污染大气的气体,
故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;
(5)铜和氧气和酸反应生成硫酸铜和水:2Cu+2H2SO4+O2═2CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2═2CuSO4+2H2O;
点评 本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.

| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失电子能力比Na的强 | |
| C. | 砹(At)是第VIIA族,其氢化物的稳定性大于HCl | |
| D. | 第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 |
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
| A. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种核素 | |
| B. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种元素 | |
| C. | Ir是主族元素 | |
| D. | 由${\;}_{77}^{193}$Ir经过中子辐射后获得${\;}_{77}^{192}$Ir是化学变化 |
①鸡蛋白溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 ⑤Fe(OH)3胶体 ⑥泥浆水.
| A. | ②④ | B. | ③④⑥ | C. | ②④⑥ | D. | ④⑥ |
| A. | 第一电离能由大到小的顺序为N>O>C | |
| B. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为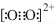 | |
| C. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |


 .
. .
. .
.