题目内容
5.下列物质的水溶液中,因水解呈酸性的是( )| A. | CO2 | B. | NaHSO4 | C. | HCl | D. | KAl (SO4)2 |
分析 电解质溶液因为电解质水解而呈酸性,说明电解质是强酸弱碱盐,据此分析解答.
解答 解:A、CO2是酸性氧化物,在溶液中和水反应生成碳酸,其溶液呈酸性,不是水解,故A错误;
B、NaHSO4是强酸强碱酸式盐,完全电离其溶液呈酸性,在溶液中不水解,故B错误;
C、HCl属于强酸,溶于水完全电离溶液显酸性,不是水解,故C错误;
D、KAl (SO4)2属于强酸弱碱盐,在溶液中铝离子水解显酸性,故D正确;
故选D.
点评 本题考查了盐类水解的原理应用判断,把握盐的组成和物质性质是解题关键,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
10.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2 的混合物,钠失去电子数为NA | |
| B. | 常温常压下,32gO2 和O3 的混合气体所含原子数为2NA | |
| C. | 22.4LCl2含有的原子数为2NA | |
| D. | 标准状况下,1molFe与22.4LCl2充分反应,转移电子数为3NA |
11.将按等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和Ba(NO3)2的混合溶液,则发生的实验现象是( )
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
13.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
20.如表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
| 不纯物质 | 除杂试荆 | 分离方法 | |
| A | NH4Cl溶液(AlCl3) | NaOH溶液 | 过滤 |
| B | 蛋白质溶液(NaCl) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| D | 四氯化碳(I2) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.下列关于胶体的说法中,正确的是( )
| A. | 胶体一定是均一、透明、介稳的 | B. | 用丁达尔效应区别胶体和溶液 | ||
| C. | 可以用滤纸来分离胶体和溶液 | D. | 胶体只能在液体中形成 |
17.下列物质属于纯净物的是( )
| A. | 玻璃 | B. | 纤维素 | C. | 天然油脂 | D. | 冰水混合物 |
14.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
| A. | 加入少量水,产生H2速率减小,H2体积不变 | |
| B. | 加入NH4HSO4固体,产生H2速率不变,H2体积不变 | |
| C. | 加入CH3COONa固体,产生H2速率减小,H2体积减小 | |
| D. | 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 |
15.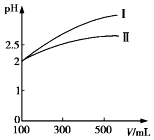 乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
①25℃时有关弱酸的电离常数如表:
②Ksp(CaCO3)=2.8×10-9.
请回答下列问题:
(1)用pH试纸检测NaCN溶液的酸碱性时,pH试纸变为蓝色.用离子方程式解释出现这种现象的原因:CN-+H2O?HCN+OH-.
(2)25℃时,测得CH3COOH与CH3COONa的混合溶液的pH=6,则$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{1}{18}$.
(3)在任一浓度的NaHCO3溶液中.c(OH-)-c(H+)=(填“>”、“=”或“<”)c(H2CO3)-c(CO32-).
(4)体积均为100mL pH=2的CH3COOH溶液与HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶液的pH变化趋势的曲线是I(填“I”或“Ⅱ”).
(5)在容器中使氯化钙溶液与碳酸钠溶液等体积混合,己知碳酸钠溶液的浓度为2×l0-4mol/L,则生成沉淀所需氯化钙溶液的最小浓度为5.6×l0-5mol/L.
 乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:①25℃时有关弱酸的电离常数如表:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | Ka=l.8×l0-5 | Ka=4.9×10-10 | Kal=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)用pH试纸检测NaCN溶液的酸碱性时,pH试纸变为蓝色.用离子方程式解释出现这种现象的原因:CN-+H2O?HCN+OH-.
(2)25℃时,测得CH3COOH与CH3COONa的混合溶液的pH=6,则$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{1}{18}$.
(3)在任一浓度的NaHCO3溶液中.c(OH-)-c(H+)=(填“>”、“=”或“<”)c(H2CO3)-c(CO32-).
(4)体积均为100mL pH=2的CH3COOH溶液与HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶液的pH变化趋势的曲线是I(填“I”或“Ⅱ”).
(5)在容器中使氯化钙溶液与碳酸钠溶液等体积混合,己知碳酸钠溶液的浓度为2×l0-4mol/L,则生成沉淀所需氯化钙溶液的最小浓度为5.6×l0-5mol/L.