题目内容
10.1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)估计钙元素的电负性的取值范围:0.8<X<1.2.
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5.
(3)某化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号)
分析 (1)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;
(2)Br的电负性小于Cl,Cl和Al的电负性差值为1.5,Br和Al的电负性差值为1.5,AlBr3中化学键为共价键;
(3)根据表格中电负性的数据可知,非金属性越强,电负性越大,对键合电子的吸引力越强.
解答 解:(1)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,故钙元素的电负性比K元素大,但小于Mg元素的电负性,即0.8<X(Ca)<1.2,
故答案为:0.8;1.2;
(2)Br的电负性小于Cl,Cl和Al的电负性差值为1.5,Br和Al的电负性差值为1.5,小于1.7,AlBr3中化学键为共价键;
故答案为:共价键;AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5;
(3)根据表格中电负性的数据可知,S电负性数值为2.3,N电负性数值为3.0,四S-N键中,该共用电子对偏向于N,
故答案为:N.
点评 本题考查电负性及与金属性非金属性的关系等,题目难度中等,清楚主族元素电负性的递变规律是解题关键.

练习册系列答案
相关题目
13.下列实验方案可行的是( )
| A. | 用溶解、过滤的方法分离碳酸钙固体和氯化钠固体 | |
| B. | 用乙醇萃取碘水中的碘 | |
| C. | 用蒸馏的方法从NaCl溶液中分离出溶质 | |
| D. | 用分液的方法分离植物油和水 |
5. 某有机物如图所示,该有机物不可能发生的化学反应是( )
某有机物如图所示,该有机物不可能发生的化学反应是( )
①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解.
 某有机物如图所示,该有机物不可能发生的化学反应是( )
某有机物如图所示,该有机物不可能发生的化学反应是( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解.
| A. | ①④ | B. | ⑦ | C. | ②⑤ | D. | ②⑦ |
15.下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
| A. | ①③ | B. | ①②③ | C. | ①③④ | D. | ①②③④ |
19.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠并探究氯水的性质.
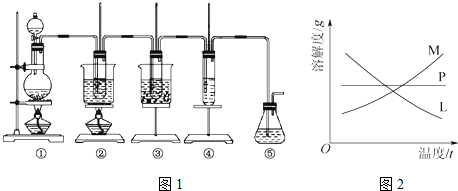
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
 (1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸.
(1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸. ,
, 通过以下路线可合成(G):
通过以下路线可合成(G):
 .
. .
. .
. ,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.
,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.