题目内容
6.下列离子方程式属于盐的水解,且书写正确的是( )| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3HDO+H+ |
分析 A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.NaHS水解生成硫化氢和氢氧根离子;
C.原子不守恒;
D.铵根离子水解结合水中氢氧根离子形成一水合氨和氢离子,依据过程分析判断.
解答 解:A.HCO3-的水解方程式为:HCO3-+H2O?H2CO3+OH-,故A正确;
B.NaHS水解反应的离子反应为HS-+H2O?H2S+OH-,故B正确;
C.硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-?Al(OH)3↓+3CO2↑,故C错误;
D.NH4Cl溶于D2O中的反应离子方程式为:NH4++D2O?NH3•DHO+D+,故D错误.
故选A.
点评 本题考查盐的水解原理的应用、离子反应方程式书写的正误判断,明确盐的水解原理和在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,难度不大.

练习册系列答案
相关题目
11.现有下列物质:①Na2CO3•10H2O晶体 ②铜 ③氯化氢 ④CO2⑤NaHSO4固体 ⑥Ba(OH)2固体⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩熔化的Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:(填编号)
(2)上述物质中有物质之间可发生离子反应:H++OH-═H2O,写出一个该离子反应对应的化学方程式Ba(OH)2+2HNO3=Ba(NO3)2+2H2O或Ba(OH)2+2HCl=BaCl2+2H2O.
(3)区别⑦和⑨的方法是丁达尔效应,将⑨滴加到⑦中至过量的实验现象是先产生红褐色沉淀,后沉淀溶解
(4)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为由弱变强
(5)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O.
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
(3)区别⑦和⑨的方法是丁达尔效应,将⑨滴加到⑦中至过量的实验现象是先产生红褐色沉淀,后沉淀溶解
(4)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为由弱变强
(5)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O.
18.同温同压下,已知O2的密度为ρg/L,则NH3的密度为( )
| A. | $\frac{32p}{17}$ g/L | B. | $\frac{17p}{32}$ g/L | C. | $\frac{32}{17p}$ g/L | D. | $\frac{17}{32p}$ g/L |
15.下列反应的离子方程式书写不正确的是( )
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 硫化钠的水解:S2-+2H2O?H2S+2OH- | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO3-+10I-+12H+=5I2+Fe2++3NO↑+6H2O | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
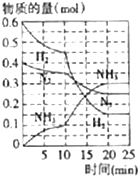 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题: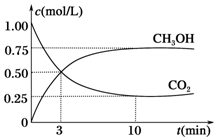 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题: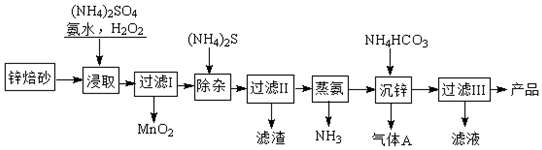
 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题: