题目内容
研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2
2Cu+SO2
②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 ,发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li--CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2
| ||
②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为
(3)①Li--CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O
| ||
(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
考点:铜金属及其重要化合物的主要性质
专题:
分析:(1)两个反应中Cu元素化合价由+2价或+2价转化为0价,发生还原反应;若用①法每制得32gCu,n(Cu)=
=0.5mol,需要硫化亚铜的物质的量为0.25mol,转移电子的物质的量=0.25mol×[4-(-2)];
(2)Cu、氧气、二氧化碳和水反应生成Cu2(OH)2CO3;正极上氧气得电子和水反应生成氢氧根离子;Zn、Cu和电解质构成原电池,Zn易失电子而作负极、Cu作正极,正极被保护;
(3)①正极上CuO得电子发生还原反应;
②阳极上铜失电子和氢氧根离子反应生成氧化亚铜和水,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水;
(4)浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动.
| 32g |
| 64g/mol |
(2)Cu、氧气、二氧化碳和水反应生成Cu2(OH)2CO3;正极上氧气得电子和水反应生成氢氧根离子;Zn、Cu和电解质构成原电池,Zn易失电子而作负极、Cu作正极,正极被保护;
(3)①正极上CuO得电子发生还原反应;
②阳极上铜失电子和氢氧根离子反应生成氧化亚铜和水,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水;
(4)浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动.
解答:
解:(1)两个反应中Cu元素化合价由+2价或+2价转化为0价,发生还原反应,所以Cu元素被还原;若用①法每制得32gCu,n(Cu)=
=0.5mol,需要硫化亚铜的物质的量为0.25mol,转移电子的物质的量=0.25mol×[4-(-2)]=1.5mol;
故答案为:还原; 1.5mol;
(2)Cu、氧气、二氧化碳和水反应生成Cu2(OH)2CO3,所以铜绿的化学式为Cu2(OH)2CO3,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;Zn、Cu和电解质构成原电池,Zn易失电子而作负极、Cu作正极,正极被保护,该方法为牺牲阳极保护法,故答案为:
Cu2(OH)2CO3;O2+2H2O+4e-=4OH-;牺牲阳极保护法;
(3)①正极上CuO得电子发生还原反应,电极反应式为CuO+2e-+2Li+=Li2O+Cu,故答案为:CuO+2e-+2Li+=Li2O+Cu;
②阳极上铜失电子和氢氧根离子反应生成氧化亚铜和水,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水,离子方程式为Cu2O+2H+=Cu2++Cu+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O; Cu2O+2H+=Cu2++Cu+H2O;
(4)浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动,则Au溶于王水中,故答案为:浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动,则Au溶于王水中.
| 32g |
| 64g/mol |
故答案为:还原; 1.5mol;
(2)Cu、氧气、二氧化碳和水反应生成Cu2(OH)2CO3,所以铜绿的化学式为Cu2(OH)2CO3,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;Zn、Cu和电解质构成原电池,Zn易失电子而作负极、Cu作正极,正极被保护,该方法为牺牲阳极保护法,故答案为:
Cu2(OH)2CO3;O2+2H2O+4e-=4OH-;牺牲阳极保护法;
(3)①正极上CuO得电子发生还原反应,电极反应式为CuO+2e-+2Li+=Li2O+Cu,故答案为:CuO+2e-+2Li+=Li2O+Cu;
②阳极上铜失电子和氢氧根离子反应生成氧化亚铜和水,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水,离子方程式为Cu2O+2H+=Cu2++Cu+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O; Cu2O+2H+=Cu2++Cu+H2O;
(4)浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动,则Au溶于王水中,故答案为:浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的[AuCl4]-离子,使反应甲平衡向右移动,则Au溶于王水中.
点评:本题以铜为载体考查氧化还原反应、原电池和电解池原理、化学平衡移动原理等知识点,侧重考查基本理论,明确各个电极上发生的反应是解本题关键,难点是书写电极反应式,题目难度中等.

练习册系列答案
相关题目
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是( )
| A、Mg、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
下列说法正确的是( )
| A、乙烷与氯气在光照条件下发生加成反应 |
| B、将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃 |
| C、甲苯能够使溴的四氯化碳溶液和酸性的高锰酸钾溶液褪色 |
| D、乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
每年5月31日为世界无烟日.吸烟有害健康,下列属于烟气中的一种有毒气体是( )
| A、O2 |
| B、N2 |
| C、CO |
| D、CO2 |
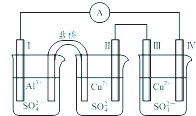 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |