题目内容
下列图示内容的对应说明错误的是( )
| A | B | C | D | |
图示 |
 |
 |
 |
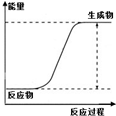 |
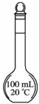
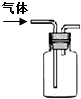
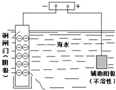
| 说明 | 该仪器用于配制一定质量分数的溶液 | 该装置可以收集二氧化氮 | 该装置可保护钢闸门不被腐蚀 | 该化学反应为吸热反应 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.容量瓶只能用于配制一定物质的量浓度溶液;
B.二氧化氮密度比空气大,可用向上排空气法收集;
C.可用外接电源的阴极保护法防止金属被腐蚀;
D.根据反应物总能量和生成物总能量的关系判断.
B.二氧化氮密度比空气大,可用向上排空气法收集;
C.可用外接电源的阴极保护法防止金属被腐蚀;
D.根据反应物总能量和生成物总能量的关系判断.
解答:
解:A.容量瓶只有一个刻度,用于配制一定体积的溶液、一定物质的量浓度溶液,不能配制一定质量分数的溶液,故A错误;
B.二氧化氮密度比空气大,可用向上排空气法收集,故B正确;
C.钢闸门连接电源负极,可被保护而不被腐蚀,故C正确;
D.反应物总能量小于生成物总能量,则为吸热反应,故D正确.
故选A.
B.二氧化氮密度比空气大,可用向上排空气法收集,故B正确;
C.钢闸门连接电源负极,可被保护而不被腐蚀,故C正确;
D.反应物总能量小于生成物总能量,则为吸热反应,故D正确.
故选A.
点评:本题考查较为综合,涉及容量瓶的使用、气体的收集、金属的腐蚀以及化学反应与能量变化等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列说法中正确的是( )
| A、25℃时,pH=7的CH3COOH与CH3COONa的混合液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) |
| B、25℃时,0.1mol/L NaHA溶液pH=3,该溶液中某些微粒的浓度大小顺序为:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、25℃时,若10mL pH=a的盐酸与100mL pH=b 的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
| D、25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
现有常温下的四份溶液:①0.01mol/L CH3COOH溶液;②0.01mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
某一反应在一定条件下的平衡转化率为25.3%,其他条件不变,有一催化剂存在时,其转化率为( )
| A、大于25.3% |
| B、小于25.3% |
| C、等于25.3% |
| D、约等于25.3% |
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是( )


| A、a为直流电源的负极 |
| B、阴极的电极反应式为:2HSO3-+2H++e-═S2O42-+2H2O |
| C、阳极的电极反应式为:SO2+2H2O-2e-═SO42-+4H+ |
| D、电解时,H+由阴极室通过阳离子交换膜到阳极室 |
下列离子方程式正确的是( )
| A、铜和稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
| B、二氧化碳通入足量澄清石灰水中:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、氧化铜溶于足量盐酸中:O2-+2H+═H2O |