��Ŀ����
ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100mLϡ�����м���������п�ۣ��ô��̶ȵļ���ƿ��ˮ���ռ�������ÿ��1���Ӽ�¼һ�����ݣ��ۼ�ֵ����
��1����0��3����ʱ����ڣ�������������������α仯�ģ��� ��
������ֱ仯����Ҫ������ ����3��5����ʱ����ڣ�������������������α仯�ģ��� ��������ֱ仯����Ҫ������ ��
��2���������зֱ����������������Һ���ܼ�����Ӧ���ʶ��ֲ����ٲ��������������� ��
A������ˮ B��NaCl��Һ C��Na2CO3��Һ D��CuSO4��Һ
��3����0��1��1��2��2��3��3��4��4��5�������ʱ����У���Ӧ��������ʱ��ε�����ķ�Ӧ����Ϊ ������Һ������䣬�����������Ϊ��������ݣ���
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������mL�� | 50 | 120 | 232 | 290 | 310 |
������ֱ仯����Ҫ������
��2���������зֱ����������������Һ���ܼ�����Ӧ���ʶ��ֲ����ٲ���������������
A������ˮ B��NaCl��Һ C��Na2CO3��Һ D��CuSO4��Һ
��3����0��1��1��2��2��3��3��4��4��5�������ʱ����У���Ӧ��������ʱ��ε�����ķ�Ӧ����Ϊ
���㣺��ѧ��Ӧ���ʵ�Ӱ������
ר�⣺��ѧ��Ӧ����ר��
��������1�����ݵ�λʱ������������������ɱȽϷ�Ӧ���ʴ�С����������ķ�ӦΪ���ȷ�Ӧ�����ŷ�Ӧ�Ľ��У��¶������ߣ���Ӧ������������Ũ��Ҳ��С����Ũ�ȼ�С��һ����Χʱ����Ӧ���ʼ�С��
��2��������Ӧ���ʣ�Ӧ���ͷ�Ӧ��Ũ�ȣ�������������������������ʵ������䣻
��3����Ӧ��������ʱ���Ϊ2��3min�����������������������������������ʵ����������ɼ��㷴Ӧ���ʣ�
��2��������Ӧ���ʣ�Ӧ���ͷ�Ӧ��Ũ�ȣ�������������������������ʵ������䣻
��3����Ӧ��������ʱ���Ϊ2��3min�����������������������������������ʵ����������ɼ��㷴Ӧ���ʣ�
���
�⣺��1���ɱ������ݿ�֪����0��3����ʱ����ڣ���λʱ�������������������������Ӧ������������п�����ᷴӦ���ȣ�ʹ��Һ�¶����ߣ���3��5����ʱ����ڣ�����������������С��ԭ�������ŷ�Ӧ���У�c��H+����С��
�ʴ�Ϊ����Ӧ����������п�����ᷴӦ���ȣ�ʹ��Һ�¶����ߣ���Ӧ������С�����ŷ�Ӧ���У�c��H+����С��
��2��������Ӧ���ʣ�Ӧ���ͷ�Ӧ��Ũ�ȣ�������������������������ʵ������䣬��ɼ���ˮ���Ȼ�����Һ�����Ȼ��Ʋ���Ӧ��������Һ��Һ�������Ũ�ȼ�С��������̼���������ᣬӰ�������������������������ͭ��Һ�γ�ԭ��ط�Ӧ���ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��AB��
��3����Ӧ��������ʱ���Ϊ2��3min���������������Ϊ232mL-120mL=112mL��n��H2��=
=0.005mol�����n��HCl��=0.01mol��
v=
=0.1 mol/��L?min����
�ʴ�Ϊ��0.1 mol/��L?min����
�ʴ�Ϊ����Ӧ����������п�����ᷴӦ���ȣ�ʹ��Һ�¶����ߣ���Ӧ������С�����ŷ�Ӧ���У�c��H+����С��
��2��������Ӧ���ʣ�Ӧ���ͷ�Ӧ��Ũ�ȣ�������������������������ʵ������䣬��ɼ���ˮ���Ȼ�����Һ�����Ȼ��Ʋ���Ӧ��������Һ��Һ�������Ũ�ȼ�С��������̼���������ᣬӰ�������������������������ͭ��Һ�γ�ԭ��ط�Ӧ���ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��AB��
��3����Ӧ��������ʱ���Ϊ2��3min���������������Ϊ232mL-120mL=112mL��n��H2��=
| 0.112L |
| 22.4L/mol |
v=
| ||
| 1min |
�ʴ�Ϊ��0.1 mol/��L?min����
���������⿼���Ϊ�ۺϣ��漰��ѧ��Ӧ���ʵ�Ӱ�������Լ����㣬Ϊ��Ƶ���㣬�����¶ȡ�Ũ�ȡ��Ӵ������ԭ��ضԷ�Ӧ���ʵ�Ӱ��Ϊ���Ĺؼ�����Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
�����Ŀ
����ͼʾ���ݵĶ�Ӧ˵��������ǣ�������
| A | B | C | D | |
ͼʾ |
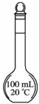 |
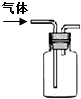 |
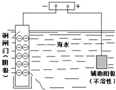 |
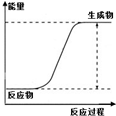 |
| ˵�� | ��������������һ��������������Һ | ��װ�ÿ����ռ��������� | ��װ�ÿɱ�����բ�Ų�����ʴ | �û�ѧ��ӦΪ���ȷ�Ӧ |
| A��A | B��B | C��C | D��D |
�����йػ��������˵������ȷ���ǣ�������
| A����ȡ���������������ȼú����������β�����������ȷ���������߿������� |
| B��������Ȼʯ��װ�Ҿӣ��ɼ������ڼ�ȩ��Ⱦ���ᵼ��һ�����ķ��������ʵ���Ⱦ |
| C�����������Ӻ�Ǧ������Pb��C2H5��4����������͵Ŀ��������ܣ������ڸ��ƴ������� |
| D��PM2.5��ʾÿ����������ֱ��С�ڻ����2.5�Ŀ�����ĺ�����PM2.5ֵԽ�ߣ�������ȾԽ���� |
 һ�����������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32������ط�ӦʽΪC2H5OH+3O2=2CO2+3H2O����ع�����ͼ�����й��ڸõ�ص�˵������ȷ����
һ�����������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32������ط�ӦʽΪC2H5OH+3O2=2CO2+3H2O����ع�����ͼ�����й��ڸõ�ص�˵������ȷ������������
| A���ŵ�����У���Դ�ڲ���H+������������Ǩ�� |
| B��ͨ���Ҵ��ĵ缫�Ǹ��� |
| C���õ�ص�������ӦΪ��4H++O2+4e-=2H2O |
| D���øõ����Ϊ��Դ���ö��Ե缫��ⱥ��NaCl��ˮ��Һʱ��ÿ����0.2 mol C2H5OH������������״������������Ϊ26.88 L |

