题目内容
19. 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
分析 A、平衡常数是温度的函数;
B、混合气体的密度一直不变;
C、正反应是放热反应,温度越高Q的体积分数越小;
D、正反应是放热反应,升高温度平衡逆向移动.
解答 解:A、平衡常数是温度的函数,温度不变,平衡常数不变,故A错误;
B、混合气体的密度一直不变,所以图象不符合,故B错误;
C、正反应是放热反应,温度越高Q的体积分数越小,所以T2<T1,故C正确;
D、正反应是放热反应,升高温度平衡逆向移动,平衡混合物物质的量增大,所以T2>T1,故D错误;
故选C.
点评 本题考查温度、压强对化学平衡移动影响,明确可逆反应特点结合“议一定二”原则分析解答,题目难度不大.

练习册系列答案
相关题目
9.已知:Ksp[Mg(OH)2]=1.8×10-11 Ksp[Zn(OH)2]=1.0×10-17
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
10.铅蓄电池是常见的二次电池,某学生用铅蓄电池进行下列实验,如图所示.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列判断错误的是( )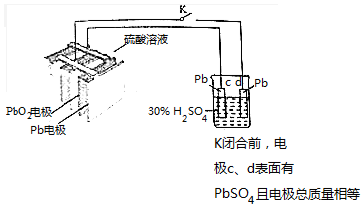

| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |
7.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 反应物X和Y的总能量一定大于生成物M和N的总能量 |
14.铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为PbS+2FeCl3=PbCl2+2FeCl2+S;
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.
4.NO因污染空气而“臭名昭著”,而奇妙的作用也使期成为“明星分子”.如可用于制HNO3.肥料.炸药.促进血管扩张.促进免疫功能.增强记忆等.下列各组物质中,不能生成NO的是( )
| A. | Cu+HNO3(稀) | B. | N2+O2 | C. | NH4Cl+O2 | D. | NO2+H2O |
11.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )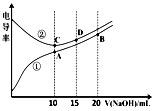

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
8.下列不属于碱的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 熟石灰 | D. | 一水合氨 |
9.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素.苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如图: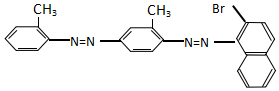
下列关于“苏丹红4号”说法正确的是( )

下列关于“苏丹红4号”说法正确的是( )
| A. | 不能发生加成反应 | B. | 属于甲苯同系物 | ||
| C. | 属于芳香烃 | D. | 能发生水解反应 |