题目内容
5.亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌.以下是制 取亚氯酸钠的工艺流程: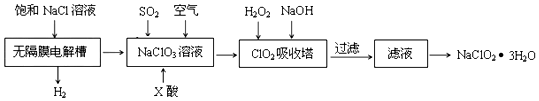
已知:ClO2气体在中性和碱性溶液中不能稳定存在,且只能保持在浓度较低状态下以防止爆炸性分解,需现合成现用.
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:Cl--6e-+6OH-=ClO3-+3H2O.
(2)反应生成ClO2气体需要X酸酸化,X酸可以为A.
A.稀硫酸 B.盐酸 C.硝酸 D.H2C2O4溶液
(3)ClO2吸收塔内的温度不能过高,其原因为:温度过高H2O2将分解
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2和CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为2ClO2+2CN-=2Cl-+2CO2+N2↑;处理100m3这种污水,反应过程转移的电子数为$\frac{250a}{13}{N}_{A}$.
分析 (1)根据电解池中阳极失去电子结合产物书写;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸、硝酸、草酸发生氧化还原反应,所以X应该是硫酸;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解;
(4)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写方程式并计算.
解答 解:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,生成氢气和NaClO3,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O;
故答案为:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在,由于在酸性条件下,氯酸钠容易和盐酸、硝酸、草酸发生氧化还原反应,所以X应该是硫酸;
故答案为:A;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解;
故答案为:温度过高H2O2将分解;
(4)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;该反应2molCN-转移10mol电子,根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,含有的CN-为$\frac{100×1{0}^{3}mL×a×{10}^{-3}mg/L}{26g/mol}$=$\frac{100a}{26}$mol,则转移电子数:$\frac{100a}{26}×\frac{10}{2}{N}_{A}$=$\frac{250a}{13}{N}_{A}$;
故答案为:2ClO2+2CN-=2Cl-+2CO2+N2↑;$\frac{250a}{13}{N}_{A}$.
点评 本题考查物质的制备实验,为高考常见题型,把握制备流程及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意氧化还原反应、电解原理的应用,题目难度不大.

| A. |  过滤 | B. |  检查容量瓶是否漏水 | ||
| C. |  气密性检查 | D. |  蒸发 |
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 |  | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
①Na②Cl③
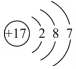 ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为
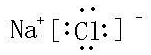 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出金属离子和酸根离子的化合物都是盐
③金属氧化物一定是碱性氧化物
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌( )
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②⑤ |
| A. | 把油倒入灶台旁的盆中,炸完食品后可倒回盆中,这样用起来比较方便 | |
| B. | 把油桶悬挂在灶台上,并在油桶上安装一个龙头,这样用起来更方便 | |
| C. | 把油分装在几个干净的玻璃瓶中密封,用完一瓶再用一瓶 | |
| D. | 把油放入一个大塑料桶中,随用随倒,比较省事 |
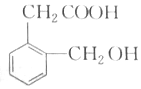 ),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.
),B与A互为同分异构体,B满足下列要求的同分异构种类为6种.