题目内容
14.如果你家买了10L油,估计可用百日左右.现有以下几种处理方法,你认为哪种最好( )| A. | 把油倒入灶台旁的盆中,炸完食品后可倒回盆中,这样用起来比较方便 | |
| B. | 把油桶悬挂在灶台上,并在油桶上安装一个龙头,这样用起来更方便 | |
| C. | 把油分装在几个干净的玻璃瓶中密封,用完一瓶再用一瓶 | |
| D. | 把油放入一个大塑料桶中,随用随倒,比较省事 |
分析 A.炸完食品后,产生致癌物质,不能重复使用;
B.油桶悬挂在灶台上,不安全,油可燃烧;
C.油分装在几个干净的玻璃瓶中密封,分次使用,减少油的氧化;
D.把油放入一个大塑料桶中,塑料中添加剂溶解在油中.
解答 解:A.炸完食品后,产生致癌物质,不能重复使用,不能食用炸完食品后的油,故A错误;
B.油桶悬挂在灶台上,不安全,油可燃烧,则不能悬挂在灶台上,故B错误;
C.油分装在几个干净的玻璃瓶中密封,分次使用,减少油的氧化,可用完一瓶再用一瓶,方法最好,故C正确;
D.把油放入一个大塑料桶中,塑料中添加剂溶解在油中,选瓷缸或不锈钢桶中,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握油脂易燃烧、氧化及有机物的溶解性为解答的关键,侧重分析与应用能力的考查,注意性质决定用途,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
2.下列说法中,不正确的是( )
| A. | NH3可以用作制冷剂 | |
| B. | 硝酸可用于制造炸药的工业原料 | |
| C. | 碳酸钠俗称纯碱,碳酸氢钠俗称苏打 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
9.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%.在用CH3C≡CH合成CH2═C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )
| A. | CO2和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和CO |
19.下列变化不属于氧化还原反应的是( )
| A. | 加热氢氧化铁固体 | B. | 金属钠露置于空气中 | ||
| C. | 灼热的铜丝放在氯气中燃烧 | D. | 将氯气通入冷的消石灰浊液中 |
3.在温度和容积不变的条件下,发生反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),能表明反应达到平衡状态的叙述是 ( )
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
4. 某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
 某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )| A. | 浓HNO3、P4(白磷) | B. | 乙醇、汞液 | ||
| C. | 氯水、KClO3 | D. | 双氧水、“84”消毒液 |
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末•,溶于浓盐酸会生成HCuC12,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题: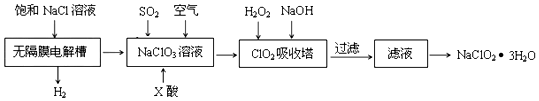
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③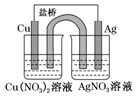 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.