题目内容
一水草酸钙(CaC2O4?H2O)可用作分离稀有金属的载体.其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中.
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品.
(1)写出步骤Ⅱ发生反应的化学方程式 .
(2)已知CaC2O4?H2O的Ksp=-2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol?L-1,c(Ca2+)的范围为 .
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率(
×100%)随温度的变化如图所示.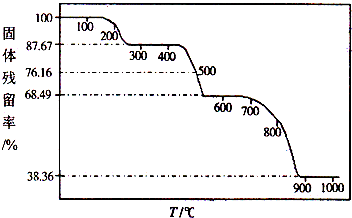
①300℃时残留固体的成分为 ,900℃时残留固体的成分为 .
②通过计算求出500℃时固体的成分及质量.(写出计算过程)
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中.
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品.
(1)写出步骤Ⅱ发生反应的化学方程式
(2)已知CaC2O4?H2O的Ksp=-2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol?L-1,c(Ca2+)的范围为
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率(
| 固体样品的剩余质量 |
| 固体样品的起始质量 |

①300℃时残留固体的成分为
②通过计算求出500℃时固体的成分及质量.(写出计算过程)
考点:探究物质的组成或测量物质的含量,难溶电解质的溶解平衡及沉淀转化的本质
专题:图示题
分析:(1)氯化钙和草酸反应生成草酸钙,草酸钙和盐酸反应生成草酸和氯化钙,加入氨水,生成一水草酸钙和氯化铵和水,据此写出反应方程式;
(2)根据溶度积常数Ksp=c(C2O42-)?c(Ca2+)来计算钙离子浓度;
(3)①由图可知:300℃固体残留率为:87.67%,100g固体中残留87.67g,t2时,900℃时固体残留率为38.36%,100g固体中残留38.36g,观察化学式:CaC2O4?H2O,其逐步分解的固体产物必为含Ca的化合物,则固体产物的物质的量应与CaC2O4?H2O相同.
设300℃和900℃时残留固体的成分A、B的相对分子质量分别为x、y,根据关系式计算A、B的相对分子质量,据此判断A、B的化学式.
②利用①方法先判断500℃时残留固体是CaC2O4和CaCO3的混合物,根据固体质量关系和物质的量关系列方程组求解.
(2)根据溶度积常数Ksp=c(C2O42-)?c(Ca2+)来计算钙离子浓度;
(3)①由图可知:300℃固体残留率为:87.67%,100g固体中残留87.67g,t2时,900℃时固体残留率为38.36%,100g固体中残留38.36g,观察化学式:CaC2O4?H2O,其逐步分解的固体产物必为含Ca的化合物,则固体产物的物质的量应与CaC2O4?H2O相同.
设300℃和900℃时残留固体的成分A、B的相对分子质量分别为x、y,根据关系式计算A、B的相对分子质量,据此判断A、B的化学式.
②利用①方法先判断500℃时残留固体是CaC2O4和CaCO3的混合物,根据固体质量关系和物质的量关系列方程组求解.
解答:
解:(1)氯化钙和草酸反应生成草酸钙,草酸钙和盐酸反应生成草酸和氯化钙,加入氨水,生成一水草酸钙和氯化铵和水,据此写出反应方程式;H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O,故答案为:H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O;
(2)由Ksp=c(C2O42-)?c(Ca2+)可知,欲使c(C2O42-)≤1.0×10-5mol?L-1,应保持溶液中c(Ca2+)≥
=
mol/L=2.34×10-4 mol/L,
故答案为:≥2.34×10-4mol/L;
(3)①设300℃和900℃时残留固体的成分A、B的相对分子质量分别为x、y,则:
由CaC2O4?H2O~~~~A
146 x
100 g 87.67 g
所以x=
=128,CaC2O4?H2O相对分子质量为146,A与 CaC2O4?H2O的相对分子质量相差18,则A为CaC2O4.
由CaC2O4?H2O~~~~~B
146 y
100g 38.36g
y=
=56,则B为CaO.
故答案为:CaC2O4;CaO;
②设600℃时残留固体的成分C的相对分子质量分别为z,
由CaC2O4?H2O~~~~C
146 z
100 g 68.49g
z=
=100,则C为碳酸钙,
由此判断500℃时残留固体是CaC2O4和CaCO3的混合物,
样品中一水草酸钙的物质的量为:
=0.25mol,设混合物中
CaC2O4和CaCO3的物质的量分别为x、y,根据500℃时固体总质量可得:128x+100y=36.50×76.16%
根据钙元素守恒,可得:x+y=0.25,解得x=0.1,y=0.15
m(CaC2O4)=0.1mol×128g/mol=12.8g,
m(CaCO3)=0.15mol×100g/mol=15.0g,
答:500℃时固体的成分为:12.8gCaC2O4和15.0gCaCO3.
(2)由Ksp=c(C2O42-)?c(Ca2+)可知,欲使c(C2O42-)≤1.0×10-5mol?L-1,应保持溶液中c(Ca2+)≥
| Ksp |
| c(C2O42-) |
| 2.34×10-9 |
| 1.0×10-5 |
故答案为:≥2.34×10-4mol/L;
(3)①设300℃和900℃时残留固体的成分A、B的相对分子质量分别为x、y,则:
由CaC2O4?H2O~~~~A
146 x
100 g 87.67 g
所以x=
| 87.67g×146 |
| 100g |
由CaC2O4?H2O~~~~~B
146 y
100g 38.36g
y=
| 38.36g×146 |
| 100g |
故答案为:CaC2O4;CaO;
②设600℃时残留固体的成分C的相对分子质量分别为z,
由CaC2O4?H2O~~~~C
146 z
100 g 68.49g
z=
| 146g×68.49g |
| 100g |
由此判断500℃时残留固体是CaC2O4和CaCO3的混合物,
样品中一水草酸钙的物质的量为:
| 36.5g |
| 146g/mol |
CaC2O4和CaCO3的物质的量分别为x、y,根据500℃时固体总质量可得:128x+100y=36.50×76.16%
根据钙元素守恒,可得:x+y=0.25,解得x=0.1,y=0.15
m(CaC2O4)=0.1mol×128g/mol=12.8g,
m(CaCO3)=0.15mol×100g/mol=15.0g,
答:500℃时固体的成分为:12.8gCaC2O4和15.0gCaCO3.
点评:本题利用图示信息确定物质化学式的计算,旨在考查理解并应用曲线及根据相关数据分析反应情况,确定反应物与产物间量的关系的能力,并据此进行相对分子质量的计算及提高化学式的推断技能,难度较大.

练习册系列答案
相关题目
吸热反应一定是( )
| A、释放能量 |
| B、反应物总能量等于生成物总能量 |
| C、反应物总能量高于生成物总能量 |
| D、贮存能量 |
25℃时,某氨水pH=x,某盐酸pH=y,已知x+y=14,且x>11,将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序是( )
| A、c(Cl-)=c(NH4+)>c(OH-)>c(H+) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |


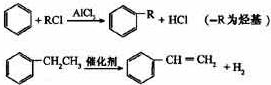 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是