题目内容
25℃时,某氨水pH=x,某盐酸pH=y,已知x+y=14,且x>11,将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序是( )
| A、c(Cl-)=c(NH4+)>c(OH-)>c(H+) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:先确定溶液的成分然后根据盐类的水解和弱电解质的电离来解题,NH3?H2O是弱电解质,HCl是强电解质,x+y=14,且x>11,混合液氨水过量,PH>7,溶液中的溶质为NH3?H2O,NH4Cl;
解答:
解:NH3?H2O是弱电解质,HCl是强电解质,x+y=14,且x>11,y小于3,混合反应一水合氨平衡状态氢氧根离子和盐酸中氢离子恰好反应,一水合氨又电离出氢氧根离子,混合液氨水过量,溶液显碱性,PH>7,溶液中的溶质为NH3?H2O,NH4Cl,一水合氨电离大于铵根离子水解,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故选:D.
故选:D.
点评:本题考查了酸碱反应后溶液酸碱性的分析判断,主要是弱电解质电离平衡的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B、1mol羟基中电子数为9NA |
| C、标准状况下,22.4L二氯甲烷的分子数约为NA |
| D、常温常压下,24.5L乙烯中C-H键数约为4NA |
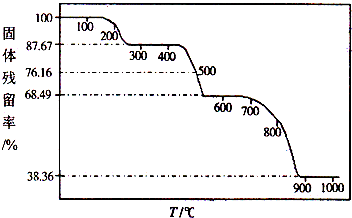

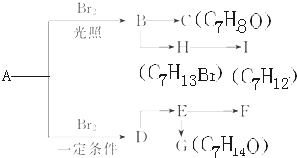

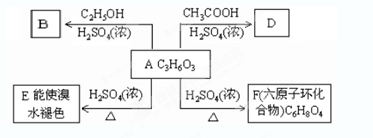
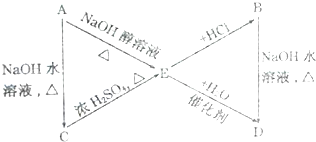
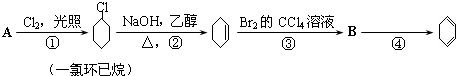
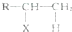 .A、B、C、D、E、M、N有下列转化关系:
.A、B、C、D、E、M、N有下列转化关系: