题目内容
4.如图是元素周期表的一部分,下列说法中正确的是( )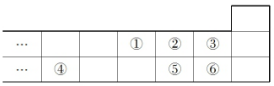
| A. | 最高价氧化物对应水化物的酸性:⑥>⑤ | |
| B. | 气态氢化物的稳定性:⑤>② | |
| C. | 元素的简单离子半径大小:④>⑤>② | |
| D. | 元素的最高正化合价:③=⑥ |
分析 由元素在周期表的位置可知,①为N,②为O,③为F,④为Al,⑤为S,⑥为Cl,
A.非金属性越强,对应最高价氧化物对应水化物的酸性越强;
B.非金属性越强,对应氢化物越稳定;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
D.F无正价.
解答 解:由元素在周期表的位置可知,①为N,②为O,③为F,④为Al,⑤为S,⑥为Cl,
A.非金属性Cl>S,对应最高价氧化物对应水化物的酸性为⑥>⑤,故A正确;
B.非金属性O>S,气态氢化物的稳定性:⑤<②,故B错误;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则元素的简单离子半径大小:⑤>②>④,故C错误;
D.F无正价,Cl的最高正价为+7,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
13. 在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
 在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为2mol | |
| C. | 反应到达平衡时,放出的热量是2a KJ | |
| D. | 15min时,v正=v逆=0 |
15.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL1mol/L的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
(1)实验四的滤液中c(Fe2+)=1.5 mol/L.
(2)原粉末样品中m(Fe):m(Cu)=7:8.
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(2)原粉末样品中m(Fe):m(Cu)=7:8.
12.下列属于纯净物的是( )
| A. | 水玻璃 | B. | 漂白粉 | ||
| C. | 盐酸 | D. | 氧元素质量分数为50%的SO2 |
19.将气体x通入氯化钡溶液,未见沉淀生成,然后通入y气体,有沉淀生成.xy不可能是( )
| A. | SO2 H2S | B. | Cl2 CO2 | C. | NH3 CO2 | D. | SO2 Cl2 |
16.下列各图曲线分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是( )
| A. |  图可以表示Si、P、S、Cl四种元素的最低负化合价的绝对值 | |
| B. | 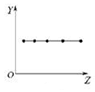 图可以表示ⅡA族元素的原子最外层电子数 | |
| C. |  图可以表示ⅥA族元素气态氢化物的稳定性 | |
| D. | 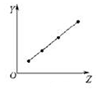 图可以表示第三周期非金属元素的最高价氧化物对应水化物的酸性 |