题目内容
9.目前,市场上有多种“热敷袋”出售.某一化学研究性学习小组在研究了某种“热敷袋”的构造后,决定自己制造一个一次性“热敷袋”,制造过程如下:①称取15g小颗粒状活性炭,40g还原铁粉,5g细木屑,都放在一只烧杯中,再加入15mL 15%食盐水,用玻璃棒搅拌均匀.②用大头针在小塑料袋上扎几十个针眼 (袋的两层同时扎穿),把烧杯里的混合物全部加入小塑料袋中,封上袋口,再放入大塑料袋中,封上袋口,可长期保存.③使用时将大塑料袋袋口打开,反复搓揉这袋5min~8min,能感觉温度明显上升.回答下列问题:(1)该一次性“热敷袋”利用了原电池原理.
(2)炭粉的作用是构成原电池正极.
(3)将使用过的“热敷袋”打开,发现有大量棕红色粉末生成,该物质主要成分是Fe2O3.
分析 根据热敷袋的原理分析:铁屑做负极,碳粉做正极,食盐做电解质溶液,再用木屑或者吸水纸之类防治漏液,一个简单的原电池原理(金属的吸氧腐蚀)就构成了热敷袋的原理,利用原电池中的氧化还原反应而发热,据此分析.
解答 解:(1)该装置符合原电池构成条件,所以能构成原电池,放电时将化学能转化为电能,所以热敷袋放出的热来自于原电池中的氧化还原反应,故答案为:原电池;
(2)炭粉构成原电池正极,正极上氧气得电子发生还原反应,NaCl溶液起电解质溶液作用,从而形成原电池,加速Fe的氧化,所以炭粉的作用是构成原电池正极,故答案为:构成原电池正极;
(3)负极上铁失电子发生氧化反应,电极反应式为2Fe-4e-═2Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,即总反应为:2Fe+O2+2H2O═2Fe(OH)2,氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁,氢氧化铁分解生成棕红色粉末氧化铁,所以使用过的“热敷袋”打开,发现有大量棕红色粉末生成,该物质主要成分是Fe2O3,故答案为:Fe2O3.
点评 本题考查原电池原理,侧重考查热敷袋的原理等知识点,注意生成铁锈原因,题目难度不大.

练习册系列答案
相关题目
18.某有机物结构为 ,以下关于它的叙述正确的是( )
,以下关于它的叙述正确的是( )
 ,以下关于它的叙述正确的是( )
,以下关于它的叙述正确的是( )| A. | 其一氯代物有2种 | B. | 其二氯代物有5种 | ||
| C. | 其分子式为C10H14 | D. | 它常温下为气态 |
20.现有下列十种物质:
①H2;②Al2O3;③CH4; ④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀盐酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O.
(3)⑦和⑩的溶液可以用丁达尔效应加以鉴别.
①H2;②Al2O3;③CH4; ④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀盐酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
(3)⑦和⑩的溶液可以用丁达尔效应加以鉴别.
17.两种硫酸溶液,一种物质的量浓度为C1mol/L,密度为ρ1g/cm3,另一种物质的量浓度为C2mol/L,密度为ρ2g/cm3,当它们等体积混合后,溶液的密度为ρ3g/cm3,则混合溶液的物质的量浓度为( )
| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| B. | <“m“:math xmlns:dsi='http://www.dessci.com/uri/2003/MathML'dsi:zoomscale='150'dsi:_mathzoomed='1'style='CURSOR:pointer; DISPLAY:inline-block'>100(C1+C2)ρ3ρ1+ρ2$\frac{100({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | |
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| D. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
4.如图是元素周期表的一部分,下列说法中正确的是( )
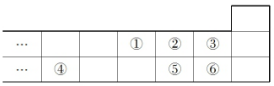

| A. | 最高价氧化物对应水化物的酸性:⑥>⑤ | |
| B. | 气态氢化物的稳定性:⑤>② | |
| C. | 元素的简单离子半径大小:④>⑤>② | |
| D. | 元素的最高正化合价:③=⑥ |
14.下列关于元素周期表和元素周期律的说法中正确的是( )
| A. | 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 元素周期表中共有18列,对应18个族 | |
| D. | 元素周期表中右上方区域的非金属元素多用于制造半导体材料 |
18.A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B与稀硫酸组成原电池时,A为电池的正极.A、B、C三种金属的活动性顺序为( )
| A. | A>B>C | B. | C>A>B | C. | C>B>A | D. | B>C>A |
19.下列排列顺序不正确的是( )
| A. | 原子半径:Na>Si>O | B. | 单质的沸点:I2>Br2>Cl2 | ||
| C. | 碱性:CsOH>KOH>NaOH | D. | 失电子能力:Al>Mg>Na |
 、⑨
、⑨ 、⑩
、⑩
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr. .
.