题目内容
16.有关化学键和晶体的说法正确的是( )| A. | 两种元素组成的晶体一定只含极性键 | |
| B. | 离子晶体一定不含非极性键 | |
| C. | 原子晶体一定含有共价键 | |
| D. | 分子晶体一定含有共价键 |
分析 A.两种元素组成的分子中可能含非极性键;
B.离子晶体也可能含非极性键;
C.原子晶体中的作用力为共价键;
D.分子晶体中可能不含化学键.
解答 解:A.两种元素组成的分子中可能含非极性键,如H-O-O-H含极性键和非极性键,故A错误;
B.离子晶体也可能含非极性键,如Na2O2含离子键和非极性键,故B错误;
C.原子晶体中的作用力为共价键,则一定含有共价键,故C正确;
D.分子晶体中可能不含化学键,如稀有气体,故D错误;
故选C.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
6.下列对分子结构及其性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子 | |
| C. | 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 | |
| D. | 酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多 |
4.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
11.化学在生产、生活中有广泛应用,下列对应关系正确的是( )
| 化学性质 | 实际应用 | |
| A | SO2具有还原性 | 用SO2漂白纸浆 |
| D | Fe3+具有氧化姓 | 硫酸铁可用作净水剂 |
| C | 维生素C易被氧气氧化 | 用作食品抗氧化剂 |
| D | H2O2受热或光照易分解 | 双氧水用作医疗上的消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
1.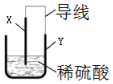 某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )
某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )
 某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )
某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )| A. | 该装置将电能转化为化学能 | B. | 电子从电极X转移到电极 Y | ||
| C. | X为阳极,表面产生大量气泡 | D. | Y为负极,电极反应为Zn-2e→Zn2+ |
8.下列过程不涉及氧化还原反应的是( )
| A. | 大气固氮 | B. | 工业制漂粉精 | ||
| C. | 用SO2漂白纸浆 | D. | 天宫一号中用Na2O2供氧 |
3.设N0为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 0.5 摩1,3-丁二烯分子中含有共价键数为5.5N0 | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9N0 | |
| C. | 1 mol-OH和1 mol OH-所含电子数都为9N0 | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8N0 |
4.NA表示阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 常温下,4.2g乙烯和丙烯的混合气体中含有的非极性键总数为0.6NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 | |
| C. | 在含有CH3COO-为1.0 mol•L-1的醋酸溶液中,H+数目略大于NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目大于3NA |

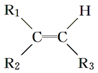 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$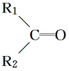 +R3COOH
+R3COOH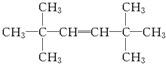 G:
G: .
.