题目内容
3.硒位于元素周期表中第4周期ⅥA族,下列对硒元素的有关叙述中,正确的是( )| A. | 硒化氢比硫化氢稳定 | |
| B. | 硒与氢气的反应比砷(位于元素周期表中第4周期VA族)与氢气的反应慢 | |
| C. | H2SeO4的酸性比H3AsO4弱 | |
| D. | 硒的原子半径比硫的大 |
分析 A、非金属性越强对应氢化物越稳定,硫的非金属性强于硒;
B、非金属性越强越易形成氢化物;
C、根据非金属性的强弱判断最高价氧化物对应水化物的酸性;
D、同主族从上往下电子层数增加,原子半径增强,所以硒的原子半径比硫的大.
解答 解:A、非金属性越强对应氢化物越稳定,硫的非金属性强于硒,所以硫化氢比硒化氢稳定,故A错误;
B、非金属性越强越易形成氢化物,而硒比砷的非金属性强,所以硒与氢气的反应比砷(位于元素周期表中第4周期VA族)与氢气的反应快,故B错误;
C、同周期元素从左到右元素的非金属性逐渐增强,非金属越强的元素,对应的最高价氧化物对应水化物的酸性越强,所以酸性H3AsO4<H2SeO4,故C错误;
D、同主族从上往下电子层数增加,原子半径增强,所以硒的原子半径比硫的大,故D正确;
故选D.
点评 本题考查元素周期表与元素周期律的关系,题目难度不大,注意元素周期律的递变规律.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
13.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:锌极:Zn+2OH--2e-=ZnO+H2O 氧化银极:Ag2O+H2O+2e-=2Ag+2OH-下列判断正确的是( )
| A. | 锌为正极,被氧化 | |
| B. | Ag2O为正极、发生还原反应 | |
| C. | 原电池工作时,电子从Ag2O极经外电路流向锌极 | |
| D. | 原电池工作时,负极附近溶液的p H值增大 |
14.关于氢键,下列说法正确的是( )
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | HF分子内存在氢键 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
18.将过量的CO2通入下列溶液中,最终出现浑浊的是( )
①CaCl2溶液;②石灰水;③饱和Na2CO3溶液;④水玻璃.
①CaCl2溶液;②石灰水;③饱和Na2CO3溶液;④水玻璃.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②④ |
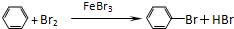
 .
. ; B 与空气反应的化学方程式2NO+O2 =2NO2.
; B 与空气反应的化学方程式2NO+O2 =2NO2.