题目内容
14.关于氢键,下列说法正确的是( )| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | HF分子内存在氢键 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
分析 氢键仅存在与电负性较强的F、O、N元素对应的氢化物中,是一种分子间作用力,但比分子间作用力强,比共价键弱,可影响物质的物理性质,以此解答该题.
解答 解:A.氢键比范德华力强,是一种介于化学键与分子间作用力之间的作用力,但不属于化学键,故A错误;
B.氢键能影响物质的熔沸点,则子间形成的氢键使物质的熔点和沸点升高,故B正确;
C.HF分子间存在氢键,故C错误;
D.H2O是一种非常稳定的化合物,与H-O键有关,而与氢键无关,故D错误;
故选B.
点评 本题考查氢键的形成与性质,题目难度不大,注意氢键与分子间作用力、化学键的区别,易错点为氢键对物质性质的影响.

练习册系列答案
相关题目
4.按碳的骨架来分类,下列说法正确的是( )
| A. |  属于链状化合物 属于链状化合物 | B. |  属于芳香烃 属于芳香烃 | ||
| C. |  属于芳香族化合物 属于芳香族化合物 | D. |  属于一种醛 属于一种醛 |
5. 美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如图,则它的化学式为( )
美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如图,则它的化学式为( )
 美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如图,则它的化学式为( )
美国《科学》杂志评选2001年世界科技十大成就中,名列第五的日本青山大学教授秋光纯发现的金属间化合物硼化镁超导转变温度高达39K,该金属间化合物的晶体结构如图,则它的化学式为( )| A. | MgB | B. | Mg2B | C. | MgB2 | D. | Mg2B3 |
9.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 35.5g Cl2中含有共价键数为NA[M(Cl)=35.5g/mol] | |
| B. | 常温常压下,22.4L CCl4含有NA个CCl4分子 | |
| C. | 1mol乙炔中含有的电子数为10NA | |
| D. | 46g NO2和N2O4的混合气体中所含原子数为3NA |
6.“绿色化学”要求从经济、环保和技术上设计可行的化学反应.据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
| A. | Mg$\stackrel{浓HNO_{3}}{→}$Mg(NO3)2 | |
| B. | Mg$\stackrel{Cl_{2}}{→}$MgCl2$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{稀HNO_{3}}{→}$Mg(NO3)2 | |
| C. | Mg$\stackrel{O_{2}}{→}$MgO$\stackrel{稀HNO_{3}}{→}$Mg(NO3)2 | |
| D. | Mg$\stackrel{浓H_{2}SO_{4}}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
3.硒位于元素周期表中第4周期ⅥA族,下列对硒元素的有关叙述中,正确的是( )
| A. | 硒化氢比硫化氢稳定 | |
| B. | 硒与氢气的反应比砷(位于元素周期表中第4周期VA族)与氢气的反应慢 | |
| C. | H2SeO4的酸性比H3AsO4弱 | |
| D. | 硒的原子半径比硫的大 |
4.某有机物的结构简式为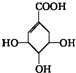 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )
 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机物能使溴的CCl4溶液褪色 | |
| B. | 该有机物在一定条件下可发生加聚反应,生成高分子化合物(C7H10O5)n | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 该有机物发生消去反应可得芳香烃 |

