题目内容
1.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )| A. | 元素的非金属性次序为c>b>a | |
| B. | a和其他3种元素均能形成共价化合物 | |
| C. | 元素b、c的气态氢化物的稳定性:b<c | |
| D. | 元素b、c的最高价氧化物对应的水化物的酸性:b>c |
分析 原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,a-的电子层结构与氦相同,则a为H元素;b和c的次外层有8个电子,则b为S元素,c为Cl元素;c-和d+的电子层结构相同,则d为K元素;结合元素化合物的性质及元素周期律解答.
解答 解:原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,a-的电子层结构与氦相同,则a为H元素;b和c的次外层有8个电子,则b为S元素,c为Cl元素;c-和d+的电子层结构相同,则d为K元素.
A.同周期自左而右非金属性增强,氢化物中H元素为正价,其非金属性最弱,故非金属性Cl>S>H,故A正确;
B.H元素与S元素、Cl元素放出形成H2S、HCl,二者属于共价化合物,H与K形成KH为离子化合物,故B错误;
C.非金属性越强,其氢化物越稳定,非金属性:Cl>S,则气态氢化物的稳定性:b<c,故C正确;
D.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S,则最高价氧化物对应的水化物的酸性:b<c,故D错误,
故选:BD.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周期律的考查,题目涉及金属氢化物是中学知识的盲点,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
11.Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
9.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
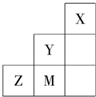

| A. | M、Z可形成ZM2分子 | B. | X原子最外层达到8电子结构 | ||
| C. | 原子半径:Z>M>Y | D. | Z2-的结构示意图可表示为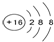 |
16.下列晶体或分子中,含有化学键类型有差异的一组是( )
| A. | NH3、NO2 | B. | NaCl、KF | C. | NaOH、Ca(OH)2 | D. | MgO、H2O2 |
13.通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A. | NCl3和SiO32-的中心原子的杂化方式相同,都是sp3杂化 | |
| B. | 分子构型为平面三角形 | |
| C. | NCl3比NBr3易挥发 | |
| D. | NC13是极性键构成的非极性分子 |
11.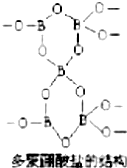 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
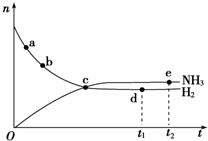 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.