题目内容
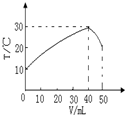 向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )| A、该实验表明化学能可以转化为热能 |
| B、NaOH溶液的浓度大于1.00mol?L-1 |
| C、V=50mL时,混合液的pH>7 |
| D、该实验表明有水生成的反应都是放热反应 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:恰好中和时混合溶液温度最高,
A.反应放热说明化学能转化为热能;
B.恰好反应时参加反应的氢氧化钠溶液的体积是40mL与50mL0.1mol/L的盐酸恰好中和,以此计算NaOH浓度;
C.V=40mL时,恰好中和;
D.根据一个反应无法得出此结论.
A.反应放热说明化学能转化为热能;
B.恰好反应时参加反应的氢氧化钠溶液的体积是40mL与50mL0.1mol/L的盐酸恰好中和,以此计算NaOH浓度;
C.V=40mL时,恰好中和;
D.根据一个反应无法得出此结论.
解答:
解:恰好中和时混合溶液温度最高,
A.温度升高说明化学能转化为热能,故A正确;
B.恰好反应时参加反应的氢氧化钠溶液的体积是40mL,由盐酸50ML可知,恰好反应时氢氧化钠溶液中溶质的物质的量是与盐酸相同,所以NaOH溶液的浓度大于1.00mol/L,故B正确;
C.V=40mL时恰好中和,所以V=50mL时溶液显碱性,pH>7,故C正确;
D.只是该反应放热,其他有水生成的反应不一定,如氯化铵和氢氧化钡晶体的反应,故D错误.
故选D.
A.温度升高说明化学能转化为热能,故A正确;
B.恰好反应时参加反应的氢氧化钠溶液的体积是40mL,由盐酸50ML可知,恰好反应时氢氧化钠溶液中溶质的物质的量是与盐酸相同,所以NaOH溶液的浓度大于1.00mol/L,故B正确;
C.V=40mL时恰好中和,所以V=50mL时溶液显碱性,pH>7,故C正确;
D.只是该反应放热,其他有水生成的反应不一定,如氯化铵和氢氧化钡晶体的反应,故D错误.
故选D.
点评:本题考查酸碱混合的定性判断和计算,题目难度不大,题目结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将0.05mol Na分别投入到盛有100mL水、100mL盐酸、100mL硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A、三个烧杯中一定均会发生的离子反应有:2Na+2H2O=2Na++2OH-+H2↑ |
| B、三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 |
| C、Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 |
| D、三个烧杯中置换生成气体的物质的量一定相同 |
闪电时空气中有臭氧生成,下列说法正确的是( )
| A、O3和O2互为同位素 |
| B、O3比O2稳定 |
| C、等质量的O3和O2含有相同的原子数 |
| D、O3与O2的相互转变是物理变化 |
有关化学用语正确的是( )
A、Be原子的结构示意图 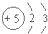 |
| B、乙醇的结构简式:C2H5OH |
| C、明矾的化学式KAlSO4?12H2O |
| D、乙烯的结构式:CH2=CH2 |
下列说法不正确的是( )
| A、需要加热方能发生的反应不一定是吸热反应 |
| B、反应是吸热还是放热取决于反应物和生成物所具有的总能量的相对大小 |
| C、测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度 |
| D、硫在氧气中燃烧,该反应反应产物的总焓大于反应物的总焓 |
下列说法正确的是:( )
①水分子之间存在氢键,所以水受热不易分解
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔化状态下能导电的物质不一定是离子化合物
⑦有单质生成的反应一定是氧化还原反应
⑧碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物.
①水分子之间存在氢键,所以水受热不易分解
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔化状态下能导电的物质不一定是离子化合物
⑦有单质生成的反应一定是氧化还原反应
⑧碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物.
| A、③⑤⑥⑦⑧ | B、②③④⑥⑦ |
| C、③⑥⑧ | D、①③④⑥ |
下列叙述正确的是( )
| A、1molH2O的质量为18g/mol |
| B、CH4的摩尔质量为16g |
| C、3.01×1023个SO2分子的质量为32g |
| D、2molNaOH溶于1L水中配成溶液的浓度为2mol?L-1 |
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |
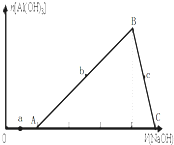 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |