题目内容
将0.05mol Na分别投入到盛有100mL水、100mL盐酸、100mL硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A、三个烧杯中一定均会发生的离子反应有:2Na+2H2O=2Na++2OH-+H2↑ |
| B、三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 |
| C、Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 |
| D、三个烧杯中置换生成气体的物质的量一定相同 |
考点:钠的化学性质
专题:
分析:钠密度小于水,钠投入溶液中,发生的反应实质是钠与酸或者水电离产生的氢离子的反应,溶液中氢离子浓度越大,反应越剧烈,生成的氢氧化钠又能够与硫酸铜发生复分解反应,据此解答.
解答:
解:A.钠投入溶液中,发生的反应实质是钠与酸或者水电离产生的氢离子的反应,钠与盐酸反应的实质为:2Na+2H+=2Na++H2↑,故A错误;
B.盐酸为酸、硫酸铜为强酸弱碱盐水解显酸性,所以X、Y、Z三种溶液中,氢离子浓度由大到小的顺序为:Y Z X,氢离子浓度越大,反应越剧烈,水中氢离子浓度最小,所以反应最缓和,故B正确;
C.钠与硫酸铜溶液反应,方程式为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故C正确;
D.依据得失电子守恒,可知相同量的钠失去电子数相同,生成氢气的量相同,故D正确;
故选:A.
B.盐酸为酸、硫酸铜为强酸弱碱盐水解显酸性,所以X、Y、Z三种溶液中,氢离子浓度由大到小的顺序为:Y Z X,氢离子浓度越大,反应越剧烈,水中氢离子浓度最小,所以反应最缓和,故B正确;
C.钠与硫酸铜溶液反应,方程式为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故C正确;
D.依据得失电子守恒,可知相同量的钠失去电子数相同,生成氢气的量相同,故D正确;
故选:A.
点评:本题考查了钠的性质,解题关键在于明确钠与溶液反应的实质,题目难度不大,注意知识的积累.

练习册系列答案
相关题目
 在密闭容器中进行反应CH4(g)+H20(g)?CO(g)+3H2(g)△H>0测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )
在密闭容器中进行反应CH4(g)+H20(g)?CO(g)+3H2(g)△H>0测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )| A、10 min时,改变的外界条件可能是温度 |
| B、0~5 min内,V(H2)=0.1 mol?L-1?min-1 |
| C、恒温下,缩小容器体积,平衡后c(H2)肯定减小 |
| D、10-12 min时反应的平衡常数逐渐增大 |
某同学在实验报告中记录下列数据,其中正确的是( )
| A、用25mL量筒量取20.06mL盐酸 |
| B、用托盘天平称取5.25g食盐 |
| C、用100mL烧杯量取80.5mL盐酸 |
| D、用广泛pH试纸测得某盐酸溶液pH在3-4之间 |
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为-57.3kJ/mol,辛烷的燃烧热为-5518kJ/mol.下列热化学方程式书写正确的是( )
| A、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1)△H=-57.3 kJ/mol | ||||
B、KOH(aq)+
| ||||
C、C8H18(l)+
| ||||
| D、2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1)△H=-5518 kJ/mol |
2009年3月29日,由山东济宁开往南京金陵石化公司的装有近30吨液氯的罐装车在京沪高速公路淮安段撞上一辆迎面驶来的货车,引起罐装液氯泄漏,造成公路旁3个乡镇的村民重大伤亡.如果你刚好住在公路旁的村子里,当你闻到氯气味时,你的选择是( )
| A、立即关闭大门,躲到床下 |
| B、伏倒在地,观察情况变化 |
| C、冲出家门,向洼地转移 |
| D、用湿毛巾捂住口腔和鼻子,朝上风口走,迅速离开村子 |
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3- |
| B、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
| C、原NaOH溶液的物质的量浓度为0.5 mol?L-1 |
| D、标准状况下产生CO2气体的体积为56mL |
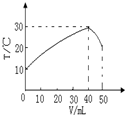 向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )| A、该实验表明化学能可以转化为热能 |
| B、NaOH溶液的浓度大于1.00mol?L-1 |
| C、V=50mL时,混合液的pH>7 |
| D、该实验表明有水生成的反应都是放热反应 |