题目内容
2.下列说法正确的是(NA表示阿伏加德罗常数)( )| A. | 0.5mol N2中含有0.5NA个N | |
| B. | 32gO2中含有的氧原子数为2NA | |
| C. | H2的摩尔质量是为2 | |
| D. | 1molH2SO4在水溶液电离出离子约为1.806×1024个 |
分析 A.结合N=nNA及物质的构成来计算,原子物质的量等于分子物质的量×原子数;
B.根据n=$\frac{m}{M}$计算出氧气的物质的量,再根据N=nNA及氧气分子构成计算出含有氧原子数目;
C.摩尔质量单位为g/mol;
D.1molH2SO4在水溶液电离出2mol氢离子和1mol硫酸根离子.
解答 解:A.0.5mol N2中含有N原子数=0.5mol×2×NA=NA个,故A错误;
B.32g氧气的物质的量为:n(O2)=$\frac{32g}{32g/mol}$=1mol,1mol氧气含有2mol氧原子,所以32g氧气中含有的氧原子数目为:N(O)=2mol×NA=2NA,故B正确;
C.H2的摩尔质量单位为2g/mol,故C错误;
D.1molH2SO4在水溶液电离出2mol氢离子和 1mol硫酸根离子,1molH2SO4在水溶液电离出离子约为3mol×6.02×1023=1.806×1024个,故D正确;
故选BD.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和微粒数的计算,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
12.甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示,对所得分子的描述,正确的是( )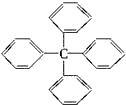

| A. | 此物质分子式为C25H18,属于苯的同系物 | |
| B. | 其一氯代物共有四种 | |
| C. | 此分子最多有13个碳原子在一个平面上 | |
| D. | 该物质能使溴水因化学反应而褪色 |
13.下列分离或提纯物质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | 硬脂酸钠 | 甘油,水 | 加NaCl | 盐析 |
| B | 乙烷 | 乙烯 | 通过KMnO4(H+)溶液 | 洗气 |
| C | C6H6 | Br2 | 加苯酚 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
10.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol•L-1,c(Cl-)为1.3mol•L-1.要使Mg2+全部转化为沉淀分离出来,至少需加4mol•L-1 NaOH溶液的体积为( )
| A. | 40 mL | B. | 72 mL | C. | 80 mL | D. | 128 mL |
17.关于下列电解质溶液的说法中,正确的是( )
| A. | 常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>(NH3•H2O)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| C. | 室温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.7×10-5,则CH3COOH溶液中c(H+)和NH3•H2O溶液中的c(OH-)相等 | |
| D. | 室温下,向0.10mol•L-1的氨水中加入少量NaOH,溶液中c(NH${\;}_{4}^{+}$)减小,Kw减小 |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO3- | |
| B. | 使PH试纸变红的溶液中:Na+、Mg2+、SO42-、NH4+ | |
| C. | c(H+)=0.1mol•L-1的溶液:Na+、NH4+、SO42-、F- | |
| D. | 与铁粉反应放出H2的无色溶液:Na+、Cl-、HCO3-、SO42- |
7.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,该同位素中子数为8,这种同位素的符号是14C.
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
4.下列有机物不能使酸性高锰酸钾褪色的是( )
| A. |  | B. | 邻甲基苯酚 | C. |  | D. | 2-甲基2-己烯 |
5.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中进行,下列表示该反应速率的值中最大的是( )
| A. | v(NH3)=0.01mol/(L•s) | B. | v(O2)=0.013mol/(L•s) | ||
| C. | v(NO)=0.012mol/(L•s) | D. | v(H2O)=0.015mol/(L•s) |