题目内容
7.下列属于氧化物的是( )| A. | O2 | B. | SO2 | C. | KCl | D. | KOH |
分析 由两种元素组成且其中一种是氧元素的化合物属于氧化物,据此解题.
解答 解:A.氧气只含一种元素,故A错误;
B.SO2由两种元素组成且其中一种是氧元素,属于氧化物,故B正确;
C.KCl不含氧元素,故C错误;
D.KOH由3种元素组成,故D错误.
故选B.
点评 本题考查物质的分类,题目难度不大,注意把握物质的组成和分类依据.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
①由上表判断,NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
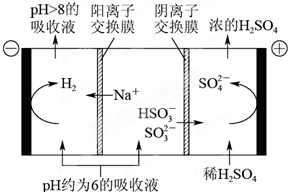
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
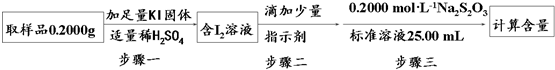
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
16.下列溶液中H+浓度为0.1mol•L-1的是( )
| A. | 0.1 mol•L-1的CH3COOH | B. | 0.1 mol•L-1的NaHSO4 | ||
| C. | 0.1 mol•L-1的NaHCO3 | D. | 0.05 mol•L-1的H2SO3 |