题目内容
5.Mg能在NO2中燃烧,产物为Mg3N2,MgO和N2.某科学小组通过实验验证部分产物并探究产物的比例关系.限用如图装置实验(夹持装置省略)资料信息:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
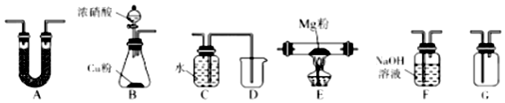
回答下列问题:
(1)利用上述装置完成实验,连接顺序为B、B、A、GF、C(填字母序号).
(2)连接好仪器,装入药品前如何检验装置气密性关闭分液漏斗活塞,将导气管末端插入水中,对B中锥形瓶微热,若导管口有气泡冒出,停止加热,导气管中进入一段水柱,表示气密性良好
(3)装置A中盛装的干燥剂可以是②④(填序号)
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(4)装置F的作用是除去过量的二氧化氮气体.
(5)要确定产物中有N2生成,观察到的实验现象为装置C中液面下降,D中出现水,确定产物中含有Mg3N2的具体实验操作为取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝色.
(6)已知装置E中初始加入镁粉的质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温,称量,测得剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况).写出玻璃管中发生反应的化学方程式:11Mg+4NO2=Mg3N2+8MgO+N2.
分析 (1)Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2,装置B中Cu与浓硝酸反应生成的气体NO2,用装置A干燥剂干燥,通入硬质玻璃管E与镁粉发生反应,用F装置除去多余的NO2,装置C和D排水法收集N2,故连接装置的顺序为:BAEGFCD;
(2)连接好仪器,装药品前装置的气密性检查方法是:装置密闭后改变装置内的压强,看导气管是否有气泡冒出,停止加热是否有液体上升设计;
(3)NO2不能用碱性干燥剂干燥,选择酸性或中性固体干燥剂;
(4)二氧化氮气体不能直接排放,用氢氧化钠吸收;
(5)确定产物中有氮气生成的实验现象为装置C中收集到大量气体,有反应Mg3N2+6H2O=3Mg(OH)2+2NH3↑,故可检验氨气的生成确定产物中含有Mg3N2;
(6)设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=0.55mol,100x+40y=21.0g
解得x=0.05,y=0.4,N2的物质的量为0.05mol,即得到方程.
解答 解:(1)Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2,装置B中Cu与浓硝酸反应生成的气体NO2,用装置A干燥剂干燥,通入硬质玻璃管E与镁粉发生反应,用F装置除去多余的NO2,装置C和D排水法收集N2,故连接装置的顺序为:BAEGFCD;
答案为:B;A;F;C;
(2)连接好仪器,装药品前装置的气密性检查方法是:关闭分液漏斗活塞,将导气管末端插入水中,对锥形瓶或B处反应管微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性完好;
故答案为;关闭分液漏斗活塞,将导气管末端插入水中,对B中锥形瓶微热,若导管口有气泡冒出,停止加热,导气管中进入一段水柱,表示气密性良好;
(3)NO2不能用碱性干燥剂干燥,U形管装的是固体干燥剂,所以干燥剂可以是无水CaCl2或五氧化二磷等;
故答案为:②④;
(4),装置F是除去过量的二氧化氮气体,2NO2+2NaOH═NaNO3+NaNO2+H2O;
故答案为:除去过量的二氧化氮气体;
(5)氮气不溶于水,如果有氮气,则能通过排水法收集到气体,所以确定产物中有N2生成的实验现象为C中试剂瓶中的水被气体压入烧杯D中;确定产物中含有Mg3N2的具体实验操作为:少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝色;
故答案为:装置C中液面下降,D中出现水;取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝色;
(6)已知装置E中初始加入Mg粉质量为13.2g,物质的量=13.2g÷24g/mol=0.55mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g为氮化镁和氧化镁,产生N2的体积为1120mL(标准状况)物质的量=1.12L÷22.4L/mol=0.05mol.
设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=0.55mol,100x+40y=21.0g
解得x=0.05,y=0.4,N2的物质的量为0.05mol,
n(Mg):n(Mg3N2):n(MgO):n(N2)=0.55:0.05:0.4:0.05=11:1:8:1:,结合氮原子守恒NO2前系数为4,
即得到11Mg+4NO2=Mg3N2+8MgO+N2,
故答案为:11Mg+4NO2=Mg3N2+8MgO+N2.
点评 本题考查了物质组成和性质的实验探究方法和组成的测定分析,实验基本操作和物质组成的计算是解题关键,题目难度中等.

| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
| A. | Na2SO4和 NaCl 的物质的量之比为 1:3 | |
| B. | 溶液中一定有 1molNa2SO4 和 3molNaCl | |
| C. | 所带电荷数 SO42-是 Na+的 $\frac{3}{5}$ 倍 | |
| D. | SO42-与 Cl-的物质的量之和等于 Na+的物质的量 |
| A. | NaOH溶液 | B. | H2SO4溶液 | C. | MgSO4溶液 | D. | FeCl3溶液 |
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
雾产生.请分别写出a仪器和c仪器的名称:三颈(烧)瓶、球形冷凝管.
(2)请写出a中发生反应的化学方程式:
 .d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
.d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
| A. | SiO32- K+ Fe3+ Cl- | B. | NO3- K+ Mg2+ SO42- | ||
| C. | ClO- Na+ HCO3- SCN- | D. | SO42- Mg2+ Cl- H+ |
| A. | 电池的电解液为碱性溶液,正极为2NiO(OH)、负极为Cd | |
| B. | 放电时,每通过2 mol电子,负极质量减轻112 g | |
| C. | 放电时,电子从正极流向电源的负极 | |
| D. | 充电时,Cd极板应与外电源的正极相接 |