题目内容
19.因实验需要小春同学需配置450mL2mol/L的稀硫酸.(1)需要量取质量分数为98%密度为1.84g/mL的浓硫酸54.3mL.(精确到0.1)
(2)配置过程中不需要下列仪器中的AG(填选项的标号).
A.托盘天平B.烧杯C.量筒D.烧杯E.玻璃棒F.胶头滴管G.试管H.容量瓶
(3)下列实验操作中,按先后顺序排列为DCAEBFHG.
A.将稀释、冷却后的硫酸沿玻璃棒注入所选容量瓶中.
B.将洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀.
C.将量取的浓硫酸沿玻璃棒缓慢注入烧杯中,搅拌并冷却至室温.
D.向烧杯中加入适量蒸馏水.
E.用适量蒸馏水洗涤烧杯2~3次.
F.向容量瓶中加蒸馏水到液面接近刻度1cm~2cm处.
G.盖上瓶塞,并反复倒转摇匀.
H.用胶头滴管加蒸馏水到瓶颈刻度处.
(4)配制过程中下列操作对所配溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)用量筒量取浓硫酸时,仰视量进行读数偏高.定容时,仰视观察容量瓶刻度线偏低.
分析 (1)依据配制溶液体积选择容量瓶规格,依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(3)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,据此排序;
(4)用量筒量取浓硫酸时,仰视量进行读数导致量取的浓硫酸体积偏大,定容时,仰视观察容量瓶刻度,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)需配制450mL2mol/L的稀硫酸,应选择500mL容量瓶,实际配制500mL溶液,质量分数为98%密度为1.84g/mL的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
故答案为:54.3;
(2)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,不需要的是:托盘天平、试管;
故选:AG;
(3)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的顺序为:DCAEBFHG;
故答案为:DCAEBFHG;
(4)用量筒量取浓硫酸时,仰视量进行读数导致量取的浓硫酸体积偏大,所含溶质硫酸的物质的量偏大,依据C=$\frac{n}{V}$可知溶液浓度偏高;
定容时,仰视观察容量瓶刻度,导致溶液体积偏大,依据C=$\frac{n}{V}$可知溶液浓度偏低;
故答案为:偏高;偏低.
点评 本题考查了一定物质的量浓度溶液的配制及有关物质的量浓度计算,明确配制原理及操作步骤是解题关键,注意熟练掌握物质的量与溶质质量分数的关系,试题培养了学生的化学计算能力.

| A. | 烧碱、纯碱、熟石灰都是碱 | B. | 铝土矿、水玻璃、小苏打都是混合物 | ||
| C. | Na2O、Al2O3、Fe2O3都是碱性氧化物 | D. | H2SO4、KOH、NaCl都是电解质 |
| A. | K+、Na+、NO3-、Br- | B. | Na+、NH4+、NO3-、Cl- | ||
| C. | K+、Na+、HCO3-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.(1)取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.则稀释过程中溶液的pH由大到小的顺序a>c>b(填字母).
②配制250mL 0.4mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
③为标定该醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
②简述用pH试纸测 0.1mol/L 醋酸溶液pH的方法:用镊子取一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照.
(3)常温下,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-)(选填“>”或“<”或“=”).
(4)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5 mol•L-1,向a L CH3COOH溶液中加入bmolCH3COONa,混合液恢复至25℃时呈中性,则原CH3COOH溶液的浓度为$\frac{b}{180a}$mol•L-1.
| A. | NaOH+NaHCO3→Na2CO3+H2O | |
| B. | Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O | |
| C. | 2NaOH+NH4HCO3→NH3?H2O+Na2CO3+H2O | |
| D. | NaOH+Ca(HCO3)2→2CaCO3↓+H2O+NaHCO3 |




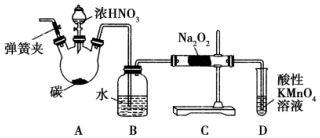 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.