题目内容
14.下列有关物质结构、粒子间的作用方式的叙述中,正确的是( )| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 冰变为液态水时,共价键没有被破坏 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
分析 A.化学键不仅存在于分子内的原子间,还存在于离子间;
B.冰变为液态水时,是分子间距离的改变,克服分子间作用力;
C.稳定性是化学性质,与氢键无关;
D.非电解质溶于水化学键不会被破坏或改变.
解答 解:A.化学键不仅存在于分子内的原子间,还存在于原子晶体内的原子间、离子晶体内的离子间,分子间作用力只存在于分子间,故A错误;
B.冰变为液态水时,是分子间距离的改变,克服分子间作用力,不破坏化学键,故B正确;
C..稳定性是化学性质,与氢键无关,与氢氟的键能大小有关,故C错误;
D.非电解质溶于水没有发生电离,化学键不会被破坏或改变,只克服分子间作用力,故D错误.
故选B.
点评 本题考查了化学键的有关知识,根据化学键的概念来分析解答,注意分子间作用力不属于化学键,氢键属于分子间作用力,不属于化学键,为易错点.

练习册系列答案
相关题目
18.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似.由此可推测BeCl2( )
| A. | 熔融不导电 | B. | 水溶液不导电 | ||
| C. | 熔点比BeBr2高 | D. | 不与NaOH溶液反应 |
2.下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A. | 原子序数X>Y>Z>W | B. | 纯净的X与纯净的Z反应生成XZ3 | ||
| C. | Z的最高正价为+6 | D. | HW是热稳定性最强的氢化物 |
9.关于周期表和周期律,下列说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
19.乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,存在与自然界的植物中,其晶体(H2C2O4•2H2O)无色,101℃开始熔化,易溶于水,受热脱水、升华,170℃时开始分解,其钠盐和钾盐易溶于水.而其钙盐难溶于水.
(1)依据表中给出的数据判断下列化学方程式可能正确的是BD(填序号)
两种多元酸是电离常数(25℃)
A.H2C2O4+CO32-═HCO3-+HC2O4-
B.HC2O4-+CO32-═HCO3-+C2O4-
C.2C2O4-+CO2+H2O═2HC2O4-+CO32-
D.H2C2O4+CO32-═C2O42-+H2O+CO2↑
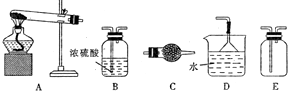
(2)某化学兴趣小组的同学选用如图所示的部分装置(可以重复选用)进行商业,验证草酸的分解产物(已知:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O↑)

如果气体流向为从左到右,装置依次连接的合理顺序为ACBDFDGHDI.
(3)草酸溶液能使酸性高锰酸钾溶液褪色,其反应历程为:

①称取3.2g草酸晶体,配制250mL0.10mol/LH2C2O4溶液
②在上述过程中必须用到的2种定量仪器是托盘天平和250mL容量瓶.
③下列操作会使所配溶液浓度偏高的是B(填序号)
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
④写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
⑤由于KMnO4能氧化水中的有机物等因素,为了配制稳定的KMnO4溶液,其浓度需标定,取10.00mL0.10mol/LH2C2O4溶液于锥形瓶中,加入10mL0.50mol/LH2SO4溶液、用KMnO4溶液滴定至锥形瓶中溶液颜色恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则上述实验中KMnO4溶液的物质的量浓度为0.01mol/L.
(1)依据表中给出的数据判断下列化学方程式可能正确的是BD(填序号)
两种多元酸是电离常数(25℃)
| 弱酸 | H2C2O4 | H2CO3 |
| 电离常数 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.5×10-7 K2=4.7×10-11 |
B.HC2O4-+CO32-═HCO3-+C2O4-
C.2C2O4-+CO2+H2O═2HC2O4-+CO32-
D.H2C2O4+CO32-═C2O42-+H2O+CO2↑
(2)某化学兴趣小组的同学选用如图所示的部分装置(可以重复选用)进行商业,验证草酸的分解产物(已知:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O↑)

如果气体流向为从左到右,装置依次连接的合理顺序为ACBDFDGHDI.
(3)草酸溶液能使酸性高锰酸钾溶液褪色,其反应历程为:

①称取3.2g草酸晶体,配制250mL0.10mol/LH2C2O4溶液
②在上述过程中必须用到的2种定量仪器是托盘天平和250mL容量瓶.
③下列操作会使所配溶液浓度偏高的是B(填序号)
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
④写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
⑤由于KMnO4能氧化水中的有机物等因素,为了配制稳定的KMnO4溶液,其浓度需标定,取10.00mL0.10mol/LH2C2O4溶液于锥形瓶中,加入10mL0.50mol/LH2SO4溶液、用KMnO4溶液滴定至锥形瓶中溶液颜色恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则上述实验中KMnO4溶液的物质的量浓度为0.01mol/L.
4.为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是( )
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | NaOH溶液 | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 溴乙烷(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |