题目内容
下列装置能达到实验目的的是

C
【解析】
试题分析:A.碘单质容易溶于酒精,因此不能用分液的方法分离,错误;B.用已知浓度的碱来滴定未知浓度的酸溶液时,NaOH溶液应该用碱式滴定管,而且不能伸入到锥形瓶中,错误;C.如果HCl容易溶于水,则烧瓶内的气体减少,使气体的压强减小,外界空气就会进入到小气球中,气球鼓起胀大。因此可以检验HCl的溶解性,正确;D.由于玻璃的导热性比较小差,所以要比较Na2CO3、NaHCO3的热稳定性,应该把Na2CO3放在内管,把NaHCO3放在外管;错误。
考点:考查化学实验装置及实验目的的完成情况的判断的知识。

练习册系列答案
相关题目
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
B.相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者
C.2CN-+H2O+CO2 = 2HCN+CO32-
D.2HCOOH+CO32-= 2HCOO-+H2O+CO2↑
几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
A.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其它原子易形成共价键而不易形成离子键

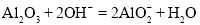
 2NO+O2在固定体积的密闭容器中反应,不能说明已达到化学平衡状态的是
2NO+O2在固定体积的密闭容器中反应,不能说明已达到化学平衡状态的是