题目内容
按下列要求填空:
(1)现有下列物质:①蔗糖 ②碳酸钙固态 ③NH3 ④硫酸 ⑤醋酸
⑥酒精水溶液 ⑦NaOH水溶液 ⑧熔融NaC l
其中属于强电解质的是 ;属于非电解质的是 ;能导电的是 .
(2)写出下列物质在水溶液中的电离方程式:
①碳酸: ②碳酸氢钠:
(3)室温下,往0.1mol/L的氨水中滴入酚酞溶液时,溶液呈粉红色,要使溶液颜色变浅,可采取以下哪些措施 .
A.加水 B.加固体氯化铵 C.加固体氢氧化钠 D.加浓盐酸
(4)已知一元酸HA在一定温度下的电离平衡常数K=1.6×10-5,初始浓度为1mol/L的HA的电离度约为 .
(5)某温度下,纯水中KW=9×10-14mol/L,此温度下,向水中加入氢氧化钠,使c(OH-)=5.0×10-5mol/L,则由水电离出得c(OH-)是 .
(1)现有下列物质:①蔗糖 ②碳酸钙固态 ③NH3 ④硫酸 ⑤醋酸
⑥酒精水溶液 ⑦NaOH水溶液 ⑧熔融NaC l
其中属于强电解质的是
(2)写出下列物质在水溶液中的电离方程式:
①碳酸:
(3)室温下,往0.1mol/L的氨水中滴入酚酞溶液时,溶液呈粉红色,要使溶液颜色变浅,可采取以下哪些措施
A.加水 B.加固体氯化铵 C.加固体氢氧化钠 D.加浓盐酸
(4)已知一元酸HA在一定温度下的电离平衡常数K=1.6×10-5,初始浓度为1mol/L的HA的电离度约为
(5)某温度下,纯水中KW=9×10-14mol/L,此温度下,向水中加入氢氧化钠,使c(OH-)=5.0×10-5mol/L,则由水电离出得c(OH-)是
考点:强电解质和弱电解质的概念,电离方程式的书写,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,能够完全电离的电解质叫做强电解质;非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)①碳酸为弱酸,存在电离平衡,且分步电离;
②碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子;
(3)溶液碱性减弱,颜色会变浅,根据电离平衡NH3?H2O?NH4++OH-的移动分析;
(4)设初始浓度为1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol,c(HA)为(1-x)mol,代入平衡常数表达式计算即可;
(5)氢氧化钠溶液中,由水电离出得c(OH-)等于溶液中氢离子的浓度,c(H+)=
计算.
(2)①碳酸为弱酸,存在电离平衡,且分步电离;
②碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子;
(3)溶液碱性减弱,颜色会变浅,根据电离平衡NH3?H2O?NH4++OH-的移动分析;
(4)设初始浓度为1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol,c(HA)为(1-x)mol,代入平衡常数表达式计算即可;
(5)氢氧化钠溶液中,由水电离出得c(OH-)等于溶液中氢离子的浓度,c(H+)=
| Kw |
| c(OH-) |
解答:
解:(1):①蔗糖不能电离出自由移动的离子,是非电解质,不导电;
②碳酸钙固态溶于水的部分完全电离,是强电解质,碳酸钙固态不导电;
③NH3自身不能电离出自由移动的离子,是非电解质,不导电;
④硫酸是强酸,属于强电解质,不导电;
⑤醋酸是弱酸,是弱电解质,不导电;
⑥酒精水溶液是混合物,不是强电解质也表示非电解质,不导电;
⑦NaOH水溶液是混合物,不是强电解质也表示非电解质,含有自由移动的离子,导电;
⑧熔融NaCl,氯化钠发生了完全电离,是强电解质,导电;
故答案为:②④⑧;①③;⑦⑧;
(2)①碳酸为弱酸,存在电离平衡,且分步电离,电离方程式为H2CO3?H++HCO3-、HCO3-?H++CO32-,
故答案为:H2CO3?H++HCO3-、HCO3-?H++CO32-;
②碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(3)A.加水,虽然催进电离,但降低了氢氧根离子的浓度,溶液颜色变浅,故A正确;
B.加固体氯化铵,增大了铵根离子的浓度,NH3?H2O?NH4++OH-的平衡向逆反应方向移动,降低了氢氧根离子的浓度,溶液颜色变浅,故B正确;
C.加固体氢氧化钠,增大了氢氧根离子的浓度,溶液颜色加深,故C错误;
D.加浓盐酸,能中和氢氧根离子,降低了氢氧根离子的浓度,溶液颜色变浅,故D正确;
故答案为:ABD;
(4)设初始浓度为1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol,c(HA)为(1-x)mol,则
K=
=
=1.6×10-5 解得:x=0.004=0.4%,
故答案为:0.4%;
(5)氢氧化钠溶液中,由水电离出得c(OH-)等于溶液中氢离子的浓度,c(H+)=
=
mol/L=1.8×10-9 mol/L,
故答案为:1.8×10-9 mol/L.
②碳酸钙固态溶于水的部分完全电离,是强电解质,碳酸钙固态不导电;
③NH3自身不能电离出自由移动的离子,是非电解质,不导电;
④硫酸是强酸,属于强电解质,不导电;
⑤醋酸是弱酸,是弱电解质,不导电;
⑥酒精水溶液是混合物,不是强电解质也表示非电解质,不导电;
⑦NaOH水溶液是混合物,不是强电解质也表示非电解质,含有自由移动的离子,导电;
⑧熔融NaCl,氯化钠发生了完全电离,是强电解质,导电;
故答案为:②④⑧;①③;⑦⑧;
(2)①碳酸为弱酸,存在电离平衡,且分步电离,电离方程式为H2CO3?H++HCO3-、HCO3-?H++CO32-,
故答案为:H2CO3?H++HCO3-、HCO3-?H++CO32-;
②碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(3)A.加水,虽然催进电离,但降低了氢氧根离子的浓度,溶液颜色变浅,故A正确;
B.加固体氯化铵,增大了铵根离子的浓度,NH3?H2O?NH4++OH-的平衡向逆反应方向移动,降低了氢氧根离子的浓度,溶液颜色变浅,故B正确;
C.加固体氢氧化钠,增大了氢氧根离子的浓度,溶液颜色加深,故C错误;
D.加浓盐酸,能中和氢氧根离子,降低了氢氧根离子的浓度,溶液颜色变浅,故D正确;
故答案为:ABD;
(4)设初始浓度为1mol/L的HA的电离度约x,则电离平衡时c(H+)、c(A-)的浓度为xmol,c(HA)为(1-x)mol,则
K=
| c(H+)?c(A-) |
| c(HA) |
| x2 |
| 1-x |
故答案为:0.4%;
(5)氢氧化钠溶液中,由水电离出得c(OH-)等于溶液中氢离子的浓度,c(H+)=
| Kw |
| c(OH-) |
| 9×10 -14 |
| 5.0×10 -5 |
故答案为:1.8×10-9 mol/L.
点评:本题考查了弱电解质在溶液中的电离,为高考高频考点,涉及电解质和非电解质、强电解质和弱电解质的辨析,溶液的导电性、电离方程式书写,电离平衡的移动等知识点,注意根据化学平衡常数的计算代入的浓度为平衡浓度.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列物质性质与应用对应关系正确的是( )
| A、氧化铁能与酸反应,可用于制作红色涂料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
下列有关说法正确的是( )
| A、油脂在酸性条件下水解可得高级脂肪酸和丙醇 |
| B、葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
| C、可利用紫色石磊试液来鉴别苯、溴苯和乙醇 |
| D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
已知在室温时纯水中存在电离平衡:H2O?H++OH-.下列叙述正确的是( )
| A、同浓度、同体积的NaOH和氨水溶液中,水的电离程度相同 |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大 |
下列说法错误的是( )
| A、化学反应中的能量变化都表现为热量变化 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的 |
| D、反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为( )
| A、正十二面体 | B、正八面体 |
| C、正六面体 | D、正四面体 |
下列物质属于纯净物的是( )
| A、氯水 | B、漂白粉 |
| C、液氯 | D、食盐水 |
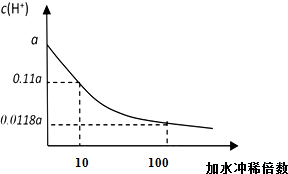 某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.
某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.