题目内容
7.25℃时,水电离出的H+浓度是5×10-13 mol•L-1的硫酸溶液中,硫酸溶液的浓度为( )| A. | 0.01mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
分析 硫酸为二元强酸,硫酸溶液中的氢离子抑制了水的电离,硫酸中的氢氧根离子是水电离的,则该溶液中氢氧根离子浓度为5×10-13 mol•L-1,结合水的离子积计算出该溶液中氢离子浓度,然后结合硫酸为二元强酸计算出硫酸的浓度.
解答 解:25℃时,由水电离出氢离子的浓度为5×10-13 mol•L-1,水的电离受到抑制,硫酸为强酸溶液,溶液中氢氧根离子是水的电离的,则该溶液中氢氧根离子浓度为5×10-13 mol•L-1,该硫酸溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{5×1{0}^{-13}}$mol/L=0.02mol/L,
硫酸为二元强酸,则硫酸的浓度为:c(H2SO4)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确酸碱溶液对水的电离的影响为解答关键,注意掌握水的离子积表达式及应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.下列设计的实验方案能达到实验目的是( )
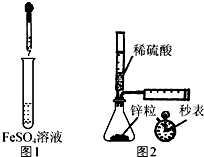

| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
15.据报道,最近科学家在宇宙中发现了H3分子,则H2和H3属于( )
| A. | 同位素 | B. | 同素异形体 | C. | 同分异构体 | D. | 同种物质 |
12.下列说法正确的是( )
| A. | 卤素元素最外层电子数都是7个,单质化学性质均较稳定 | |
| B. | 卤素元素的单质从上到下熔、沸点依次升高 | |
| C. | 卤素元素的单质从上到下颜色逐渐变浅 | |
| D. | 卤素元素从上到下随电子层数的增多非金属性也依次增强 |
16.烯烃在一定条件下发生氧化反应时碳碳双键发生断裂:RCH═CHR′$\stackrel{一定条件}{→}$RCHO+R′CHO,在该条件下,下列烯烃分别经过上述条件氧化后产物可以生成甲醛的是( )
| A. | CH3CH═CH(OH2)2CH3 | B. | CH2═CH(CH2)2CH3 | ||
| C. | CH3CH═CH-CH═CHCH3 | D. | CH3CH2═CHCH2CH3 |
17.如表为元素周期表的一部分用元素符号或化学式回答下列问题
(1)写出⑥与⑧元素组成的分子的电子式: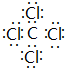 .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2 Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式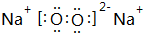 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
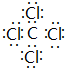 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2 Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号). 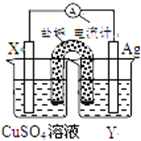 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.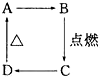 如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.
如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.