题目内容
15.据报道,最近科学家在宇宙中发现了H3分子,则H2和H3属于( )| A. | 同位素 | B. | 同素异形体 | C. | 同分异构体 | D. | 同种物质 |
分析 由同种元素组成的不同单质互为同素异形体.
解答 解:H3和H2都是由氢元素形成的不同单质,属于同素异形体,故选B.
点评 本题考查同素异形体的概念,难度不大.对于同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
相关题目
6.某实验小组对影响铝与盐酸反应的快慢的因素进行探究.下表是实验记录的数据.
(1)写出铝与盐酸反应的离子方程式:2Al+6H+=2Al3++3H2↑;
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
10.一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,关于检验该信息素中官能团的试剂和顺序,下列说法正确的是( )
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
20.卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
| A. | 卤素元素原子最外层电子数都是7 | B. | 从氟到碘,卤素原子半径依次减小 | ||
| C. | 卤素元素单质均为气态 | D. | 从氟到碘,非金属性逐渐增强 |
7.25℃时,水电离出的H+浓度是5×10-13 mol•L-1的硫酸溶液中,硫酸溶液的浓度为( )
| A. | 0.01mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
4.科学家预测原子序数为114的元素具有相当稳定的同位素,它的位置是在第七周期、第ⅣA族,称为“类铅”,关于它的性质的预测错误的是( )
| A. | 它的原子最外层有4个电子 | |
| B. | 它具有+2、+4价 | |
| C. | 金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质 | |
| D. | 它的金属性比铅强 |
5.下列说法正确的是( )
| A. |  属于酯类 属于酯类 | B. | 乙醛的结构简式为CH3COH | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 苯的实验式为C6H6 |
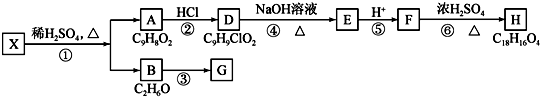
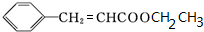 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$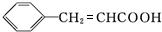 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.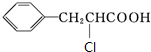 .
.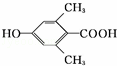 、
、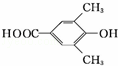 .
.