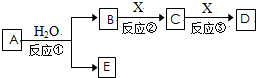
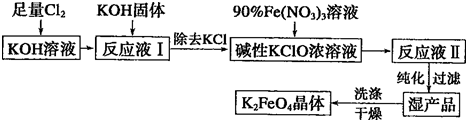
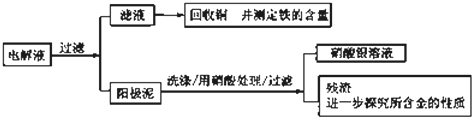
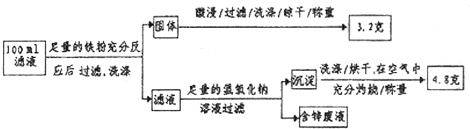
题目内容
用惰性电极电解含有0.400molCu(NO3)2和0.400mol KCl的混合溶液,一段时间后,在一个电极上析出0.300mol Cu,此时在另一电极上放出的气体在标准状况下的体积(标准状况下)为( )
| A、3.36L |
| B、6.72L |
| C、5.60L |
| D、2.80L |
考点:电解原理
专题:电化学专题
分析:电解混合溶液时,阴极发生Cu2++2e-=Cu,可知阴极得到0.6mol电子,阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,结合两极转移电子数目相等和电极方程式计算.
解答:
解:阴极发生Cu2++2e-=Cu,可知阴极得到0.6mol电子,
阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,氯离子完全析出时,生成n(Cl2)=0.2mol,转移电子0.4mol,
则生成氧气转移电子0.2mol,生成氧气0.05mol,
所以阳极共生成(0.2+0.05)mol=0.25mol气体,
气体体积=0.25mol×22.4L/mol=5.6L,
故选C.
阳极发生:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,氯离子完全析出时,生成n(Cl2)=0.2mol,转移电子0.4mol,
则生成氧气转移电子0.2mol,生成氧气0.05mol,
所以阳极共生成(0.2+0.05)mol=0.25mol气体,
气体体积=0.25mol×22.4L/mol=5.6L,
故选C.
点评:本题以电解原理为载体考查了物质的量的有关计算,明确阳极上析出气体的成分再结合转移电子相等即可解答,题目难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
一定温度下,反应SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0.现将1mol SO2(g)和2mol CO(g)充入某恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A、 |
B、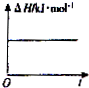 |
C、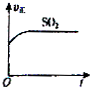 |
D、 |
应用纳米新材料能给人民币进行杀菌、消毒.我国纳米专家王雪平发明的“WXP复合纳米材料”的主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用.有鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去.若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有( )
| A、7种 | B、8 种 |
| C、9种 | D、10种 |
用NaOH固体配制1mol/L的NaOH溶液,下列操作和说法中正确的是( )
| A、配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
| B、称量时,将固体NaOH放在托盘天平左盘纸片上 |
| C、固体溶解后冷却到室温,然后将溶解后溶液转移到容量瓶中,立即向容量瓶中直接加水稀释到刻度线 |
| D、将40gNaOH固体溶于1 L水中可配成1mol/L的NaOH溶液 |
恒温恒容条件下,进行以下反应:H2(g)+Br2(g)?2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr.在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是( )
| A、达平衡时HBr物质的量一定仍为a mol | ||
| B、两平衡压强比为3:(x+y+z) | ||
C、达平衡时HBr的物质的量为
| ||
| D、x、y、z应满足的关系是 4x+z=2y |