题目内容
另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
步骤一:电解精制:电解时,粗铜应与电源的 极相连.阴极上的电极反应式为 .
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
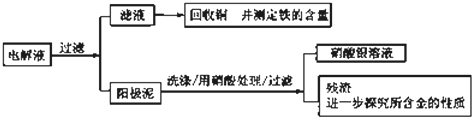
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: ,残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
请根据以上信息简要解释溶解阳极泥不用王水的原因 .
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程.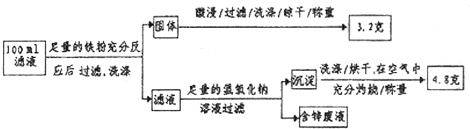
则100mL滤液中Cu2+的浓度为 mol?L-1,Fe2+的浓度为 mol?L-1.
步骤一:电解精制:电解时,粗铜应与电源的
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H20 | <<1 |
| 2 | Au3++4Cl-?AuCl4 _ | >>1 |
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程.

则100mL滤液中Cu2+的浓度为
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题,电化学专题
分析:步骤一:电解精炼铜时,精铜做阴极,粗铜作阳极,阴极上是铜离子得电子;
步骤二:(1)金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;金离子可以和氯离子之间发生反应,形成稳定的AuCl4-离子,可以根据化学平衡移动原理来解释;
(2)根据化学反应原理结合原子守恒的思想来计算回答.
步骤二:(1)金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;金离子可以和氯离子之间发生反应,形成稳定的AuCl4-离子,可以根据化学平衡移动原理来解释;
(2)根据化学反应原理结合原子守恒的思想来计算回答.
解答:
解:步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,阴极上是铜离子得电子产生铜,精铜做阴极,粗铜作阳极,
故答案为:正;Cu2++2e=Cu;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O;根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=
=
=0.5 mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:
×2=0.06mol,所以亚铁离子的浓度c=
=
=0.6mol/L,故答案为:0.5;0.6.
故答案为:正;Cu2++2e=Cu;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O;根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=
| n |
| V |
| 0.05mol |
| 0.1L |
| 4.8g |
| 160g/mol |
| n |
| V |
| 0.06mol |
| 0.1L |
点评:本题考查有关电解精炼铜、化学平衡移动原理以及物质的含量的测定的综合知识,为高频考点,注意把握实验方法设计与装置的综合分析,题目难度中等.

练习册系列答案
相关题目
只用水不能鉴别的一组物质是( )
| A、乙醇和乙酸 | B、苯和乙醇 |
| C、苯和四氯化碳 | D、苯和溴苯 |
用惰性电极电解含有0.400molCu(NO3)2和0.400mol KCl的混合溶液,一段时间后,在一个电极上析出0.300mol Cu,此时在另一电极上放出的气体在标准状况下的体积(标准状况下)为( )
| A、3.36L |
| B、6.72L |
| C、5.60L |
| D、2.80L |
现有烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、500ml容量瓶、蒸发皿、圆底烧瓶、铁架台(带铁圈)、三脚架、石棉网、火柴、滤纸.若所需试剂均有提供,在以下5个实验中:①沉淀的过滤,②配制500ml 1mol/LNaCl溶液,③溴的萃取,④蒸馏,⑤硫酸铜溶液的蒸发浓缩.其中因缺乏某种实验用品而不能完成的实验是( )
| A、① | B、①和④ |
| C、③和⑤ | D、②和④ |
用自来水(用Cl2消毒)养金鱼时,将水注入鱼缸的前需在阳光下暴晒一段时间,目的是( )
| A、使水的温度升高 |
| B、增加水中O2的含量 |
| C、起到杀菌作用 |
| D、使水中HClO分解 |
 现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:
现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:


