题目内容
已知W、X、Y、Z为四种短周期元素,原子序数逐渐增大.其中W形成的单质是自然界中最轻的气体;X原子的最外层电子数是次外层电子数的2倍;Y元素是地壳中含量最多的元素;Z元素是短周期中原子半径最大的元素.回答下列问题:
(1)X6W6的结构简式为 ,分子空间构型为 .
(2)Y与Z形成的两种常见化合物的电子式分别为 和
(3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种,其中A的相对分子质量是60,是日常生活中的一种调味品的主要成分,则A的结构简式为 ;B的相对分子质量是A的3倍,在正常人的血液里含有0.1%的B,则B的分子式 .将B物质的溶液与新制的Cu(OH)2悬浊液共热,观察到得现象是 .
(4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体.写出该反应的化学方程式
(5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式 .C还可以在Cu或Ag的催化作用下被氧气氧化成具有刺激性气味的液体,该反应的化学方程式为 .
(1)X6W6的结构简式为
(2)Y与Z形成的两种常见化合物的电子式分别为
(3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种,其中A的相对分子质量是60,是日常生活中的一种调味品的主要成分,则A的结构简式为
(4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体.写出该反应的化学方程式
(5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z为四种短周期元素,原子序数逐渐增大.W形成的单质是自然界中最轻的气体,则W为H元素;X原子的最外层电子数是次外层电子数的2倍,X原子只能有2个电子层,最外层电子数为4,则X为C元素;Y元素是地壳中含量最多的元素,则Y为O元素;Z元素是短周期中原子半径最大的元素,则Z为Na元素,据此解答.
解答:
解:W、X、Y、Z为四种短周期元素,原子序数逐渐增大.W形成的单质是自然界中最轻的气体,则W为H元素;X原子的最外层电子数是次外层电子数的2倍,X原子只能有2个电子层,最外层电子数为4,则X为C元素;Y元素是地壳中含量最多的元素,则Y为O元素;Z元素是短周期中原子半径最大的元素,则Z为Na元素,
(1)C6H6是苯,结构简式为 ,分子空间构型为平面正六边形,
,分子空间构型为平面正六边形,
故答案为: ;平面正六边形;
;平面正六边形;
(2)O与Na形成的两种常见化合物为Na2O、Na2O2,电子式分别为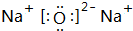 和
和 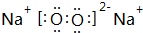 ,
,
故答案为: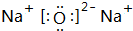 ;
; ;
;
(3)由H、C、O三种元素形成的最简式为CH2O的化合物有A和B两种,其中A的相对分子质量是60,分子式为C2H4O2,是日常生活中的一种调味品的主要成分,则A为醋酸,结构简式为CH3COOH;
B的相对分子质量是A的3倍,B的分子式为C6H12O6,在正常人的血液里含有0.1%的B,B为葡萄糖,将B物质的溶液与新制的Cu(OH)2悬浊液共热,有生成氧化亚铜,观察到得现象是:有砖红色沉淀产生,
故答案为:CH3COOH;C6H12O6;有砖红色沉淀产生;
(4)将B(葡萄糖)在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体,反应生成酒精与二氧化碳,反应方程式为:C6H12O6
2C2H5OH+2CO2↑,
故答案为:C6H12O6
2C2H5OH+2CO2↑;
(5)酒精燃烧生成二氧化碳与水,反应化学方程式为:C2H5OH+3O3
2CO2+3H2O,酒精可以在Cu或Ag的催化作用下被氧气氧化成具有刺激性气味的液体,反应生成乙醛,该反应的化学方程式为:2C2H5OH+O2
2CH3CHO+2H2O,
故答案为:C2H5OH+3O3
2CO2+3H2O;2C2H5OH+O2
2CH3CHO+2H2O.
(1)C6H6是苯,结构简式为
 ,分子空间构型为平面正六边形,
,分子空间构型为平面正六边形,故答案为:
 ;平面正六边形;
;平面正六边形;(2)O与Na形成的两种常见化合物为Na2O、Na2O2,电子式分别为
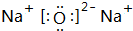 和
和  ,
,故答案为:
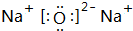 ;
; ;
;(3)由H、C、O三种元素形成的最简式为CH2O的化合物有A和B两种,其中A的相对分子质量是60,分子式为C2H4O2,是日常生活中的一种调味品的主要成分,则A为醋酸,结构简式为CH3COOH;
B的相对分子质量是A的3倍,B的分子式为C6H12O6,在正常人的血液里含有0.1%的B,B为葡萄糖,将B物质的溶液与新制的Cu(OH)2悬浊液共热,有生成氧化亚铜,观察到得现象是:有砖红色沉淀产生,
故答案为:CH3COOH;C6H12O6;有砖红色沉淀产生;
(4)将B(葡萄糖)在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体,反应生成酒精与二氧化碳,反应方程式为:C6H12O6
| 酒化酶 |
故答案为:C6H12O6
| 酒化酶 |
(5)酒精燃烧生成二氧化碳与水,反应化学方程式为:C2H5OH+3O3
| 点燃 |
| Cu |
| △ |
故答案为:C2H5OH+3O3
| 点燃 |
| Cu |
| △ |
点评:本题考查结构性质位置关系应用、有机物的结构与性质等,难度不大,需要学生熟练掌握有机物基础知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,1摩尔甲醇的体积约为22.4L |
| B、1摩尔庚烷中含有的共用电子对数为23摩尔 |
| C、1摩尔氢氧根离子(OH-)与羟基(-OH)所含电子数均为10NA |
| D、2.8 g乙烯与丙烯的混合物中含总原子的数目为0.6NA |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、2.7 g 金属铝所含电子数目为0.3N |
| B、16 g CH4所含原子数目NA |
| C、17 g NH3所含电子数目为NA |
| D、18 g 水所含分子数目为NA |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH- |
| B、充电时阴极反应为:Zn(OH)2+2e-═Zn+2OH- |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、充电时阳极附近溶液的pH减小 |
 如图装置闭合电键时,电流计A的指针将发生偏转.试回答下列问题.
如图装置闭合电键时,电流计A的指针将发生偏转.试回答下列问题. 甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.
甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.