题目内容
以下四种共价键分子的球棍模型中,可表示Cl2分子的是( )
A、 |
B、 |
C、 |
D、 |
考点:球棍模型与比例模型
专题:
分析:氯气分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连,氯原子大小相同,以此来解答.
解答:
解:A、两种原子大小不同,故不是氯气,故A错误;
B、氯气原子的最外层均达到8电子稳定结构,原子间以单键相连,氯原子大小相同,故B正确;
C、氯气分子只含有2个原子,为直线形,此球棍模型中含有3个原子,且大小不同,故C错误;
D、含有5个原子,且为正四面体形,可能为甲烷,故D错误,
故选B.
B、氯气原子的最外层均达到8电子稳定结构,原子间以单键相连,氯原子大小相同,故B正确;
C、氯气分子只含有2个原子,为直线形,此球棍模型中含有3个原子,且大小不同,故C错误;
D、含有5个原子,且为正四面体形,可能为甲烷,故D错误,
故选B.
点评:本题主要考查的是球棍模型,为高频考点,把握原子以单键相连为解答的关键,侧重分析、推断能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用惰性电极电解CuSO4溶液一段时间后,停止电解向所得溶液中加入0.2molCu(OH)2,恰好反应时溶液浓度恢复至电解前,关于电解过程说法不正确的是( )
| A、生成的铜的物质的量是0.2mol |
| B、随着电解进行溶液的pH减小 |
| C、转移电子的物质的量为0.4mol |
| D、阳极反应是40H--4e-=2H20+O2尹 |
下列有关原子结构、元素性质的说法正确的是( )
| A、Si、P、S、Cl元素的单质与氢气化合越来越容易 |
| B、元素原子最外层电子数越多,元素金属性越强 |
| C、元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族 |
| D、F-、O2-、Mg2+、Na+离子半径逐渐减小 |
下列各项表达式正确的是( )
A、N2的电子式: |
| B、二氧化碳分子的结构式为 O-C-O |
C、NaCl的电子式: |
D、F-的结构示意图: |
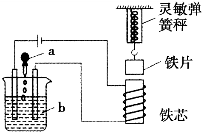 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |
 室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol/LHCl滴定10mL0.1mol/LNa2CO3,滴定曲线如图所示.下列说法正确的是( )| A、水电离程度由大到小的顺序为:a>b>c>d |
| B、a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| C、b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| D、d点时:c(H+)>c(HCO3-)=c(CO32-) |