题目内容
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A、ρ=
| ||
B、ω=
| ||
C、ω=
| ||
D、c=
|
考点:物质的量浓度的相关计算
专题:计算题
分析:A、由表达式可知,该密度=
,溶液体积不等于氨气体积;
B、根据c=
进行计算;
C、根据n=
计算氨气的物质的量,根据m=nM计算氨气的质量,利用m=ρV计算水的质量,根据溶质质量分数=
×100%计算
D、由表达式可知,c=
,溶液体积不等于氨气体积与水的体积之和.
| 溶液质量 |
| 氨气体积 |
B、根据c=
| 1000ρω |
| M |
C、根据n=
| V |
| Vm |
| 氨气质量 |
| 溶液质量 |
D、由表达式可知,c=
| 溶质物质的量 |
| 氨气体积+水的体积 |
解答:
解:A、由表达式可知,该密度=
,溶液体积不等于氨气体积,故A错误;
B、c=
可知,该溶液氨气质量分数ω=
,故B正确;
C、氨气的物质的量为
=
mol,故氨气的质量为
mol×17g/mol=
g,1L水的质量为1000g,故该溶液的质量分数为ω=
×100%=
,故C正确;
D、由表达式可知,c=
,溶液体积不等于氨气体积与水的体积之和,应根据密度计算,故D错误;
故选AD.
| 溶液质量 |
| 氨气体积 |
B、c=
| 1000ρω |
| M |
| 17c |
| 1000ρ |
C、氨气的物质的量为
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 17V |
| 22.4 |
| ||
|
| 17V |
| 17V+22400 |
D、由表达式可知,c=
| 溶质物质的量 |
| 氨气体积+水的体积 |
故选AD.
点评:考查质量分数、物质的量浓度的有关计算,难度中等,注意公式的理解与灵活运用,题目为字母型计算,计算量较大,需要学生细心观察进行计算.

练习册系列答案
相关题目
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L. 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g.再将得到的沉淀灼烧至质量不再改变为止,得到固体p g.则下列关系不正确的是( )
A、c=
| ||
B、p=m+
| ||
| C、n=m+0.017Vc | ||
D、n=p+
|
一定量的Fe和Fe2O3混合物投入1mol?L-1 300mL 的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标准状况),再向反应后溶液中加入1mol?L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
| A、200mL |
| B、245mL |
| C、250mL |
| D、300mL |
向某烧碱溶液中通入5.28gCO2后,将溶液在低温下蒸干,得到固体物质的质量为17.32g,则该固体物质是( )
| A、Na2CO3 |
| B、NaHCO3 |
| C、Na2CO3和NaOH |
| D、Na2CO3和NaHCO3 |
下列实验操作中,不合理的是( )
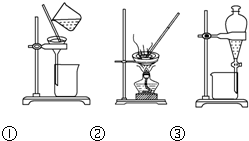

| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
30g某一元醇与足量的金属钠完全反应,在标准状况下得到5.6L氢气.该物质可能是( )
| A、CH3OH |
| B、C2H5OH |
| C、C3H7OH |
| D、C4H9OH |
