题目内容
针对下表中的9种元素,用化学用语回答下列问题:
(1)写出 ⑧的原子结构示意图:
(2)形成物质种类最多的元素是
(3)用电子式表示①和⑨形成化合物的过程
(4)⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是
(5)工业上冶炼⑥的单质选用的方法是
(6)写出⑦的单质与三氧化二铁反应的化学方程式
(7)写出③和⑧的最高正价氧化物对应水化物的浓溶液与一种结构为平面正六边形分子式为C6H6的物质反应的化学方程式: .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(2)形成物质种类最多的元素是
(3)用电子式表示①和⑨形成化合物的过程
(4)⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是
(5)工业上冶炼⑥的单质选用的方法是
(6)写出⑦的单质与三氧化二铁反应的化学方程式
(7)写出③和⑧的最高正价氧化物对应水化物的浓溶液与一种结构为平面正六边形分子式为C6H6的物质反应的化学方程式:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl,
(1)S元素质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6;
(2)碳元素是构成有机物的骨架元素,形成物质的种类最多;
(3)①和⑨形成的化合物为HCl,属于共价化合物,分子中H原子与Cl之间形成1对共用电子对,用H原子、Cl元素的电子式表示其形成过程;
(4)同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱;
(5)工业上,通常电解熔融的氯化镁冶炼镁;
(6)铝与氧化铁在高温条件下反应生成铁与氧化铝;
(7)苯与浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯与水.
(1)S元素质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6;
(2)碳元素是构成有机物的骨架元素,形成物质的种类最多;
(3)①和⑨形成的化合物为HCl,属于共价化合物,分子中H原子与Cl之间形成1对共用电子对,用H原子、Cl元素的电子式表示其形成过程;
(4)同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱;
(5)工业上,通常电解熔融的氯化镁冶炼镁;
(6)铝与氧化铁在高温条件下反应生成铁与氧化铝;
(7)苯与浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯与水.
解答:
解:根据元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl,
(1)S元素质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)碳元素是构成有机物的骨架元素,形成物质的种类最多,故答案为:C;
(3)①和⑨形成的化合物为HCl,分子中H原子与Cl之间形成1对共用电子对,用H原子、Cl元素的电子式表示其形成过程为: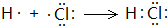 ,
,
故答案为: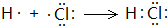 ;
;
(4)Na、Mg、Al同周期,自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱,故碱性NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(5)工业上,通常电解熔融的氯化镁冶炼镁,故答案为:电解法;
(6)铝与氧化铁在高温条件下反应生成铁与氧化铝,反应方程式为:Al+Fe2O3
Fe+Al2O3,故答案为:Al+Fe2O3
Fe+Al2O3;
(7)苯与浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯与水,反应方程式为:C6H6+HNO3
C6H5NO2+H2O,故答案为:C6H6+HNO3
C6H5NO2+H2O.
(1)S元素质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)碳元素是构成有机物的骨架元素,形成物质的种类最多,故答案为:C;
(3)①和⑨形成的化合物为HCl,分子中H原子与Cl之间形成1对共用电子对,用H原子、Cl元素的电子式表示其形成过程为:
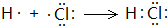 ,
,故答案为:
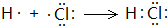 ;
;(4)Na、Mg、Al同周期,自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱,故碱性NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(5)工业上,通常电解熔融的氯化镁冶炼镁,故答案为:电解法;
(6)铝与氧化铁在高温条件下反应生成铁与氧化铝,反应方程式为:Al+Fe2O3
| ||
| ||
(7)苯与浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯与水,反应方程式为:C6H6+HNO3
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
点评:本题考查元素周期表与元素周期律的综合应用,比较基础,需要学生熟练掌握元素周期表,注意掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现在CO和CO2两种气体,它们所含氧原子的物质的量均为1mol,则 CO与CO2的分子数之比为( )
| A、1:1 | B、1:2 |
| C、2:1 | D、3:2 |
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.有关说法不正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.有关说法不正确的是( )| A、还原性I->Fe2+>Br- |
| B、原混合溶液中n(FeBr2)=4mol |
| C、当通入Cl2 2mol时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| D、原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
在无色透明强酸性溶液中,能大量共存的离子组是( )
| A、K+、Cu2+、NO3-、SO32- |
| B、K+、Na+、Cl-、SiO32- |
| C、Al3+、NH4+、NO3-、Cl- |
| D、K+、Na+、AlO2-、Cl- |
 过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
