题目内容
19.下列各分子中,所有原子都满足最外层8电子稳定结构的是( )| A. | H2O | B. | BF3 | C. | CCl4 | D. | LiCl |
分析 分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构,由此分析解答.
解答 解:A.H2O分子中含有的共价键是极性共价键,且H原子不满足8电子稳定结构,故A错误;
B.BF3中,B元素位于第ⅢA族,则3+3≠8,则不满足分子中所有原子都满足最外层8电子结构,故B错误;
C.CCl4分子中C原子最外层电子数是4,4+4=8,Cl原子最外层电子数是7,1+7=8,所以各原子最外层都满足8电子稳定结构,故C正确;
D.LiCl离子化合物中锂离子,最外层只有2个电子,故D错误;
故选C.
点评 本题考查原子核外电子数,明确元素的位置、最外层电子数、成键数即可判断,注意规律的应用来解答,题目难度不大.

练习册系列答案
相关题目
10.下列说法错误的是( )
| A. | 向苦卤(含K+、Mg2+、Br-等)中通入Cl2是为了提取溴 | |
| B. | 粗盐(含Ca2+、Mg2+、SO42-、泥沙等杂质)可采用除杂和重结晶等过程提纯 | |
| C. | 海带提碘只涉及物理变化,海水提镁涉及复分解反应 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
14.下列物质属于同位素的一组是( )
| A. | O2与O5 | |
| B. | 1H和2H | |
| C. | 淀粉和纤维素 | |
| D. | CH3-CH2-CH2-CH3与 CH3-CH (CH3)-CH3 |
4.在无色水溶液中可以大量共存的离子组是( )
| A. | HSO3-、Ba2+、OH-、Na+ | B. | Na+、HCO3-、Ca2+、Cl- | ||
| C. | SO42-、OH-、NH4+、H+ | D. | MnO4-、Cl-、ClO-、K+ |
11.下列有关实验描述说法正确的是( )
| 选项 | 实验描述 |
| A | 将SO2通入到紫色石蕊溶液中,溶液先变红后褪色 |
| B | 将SO2通入到KMnO4(H+)溶液中,紫色褪去 |
| C | 将Cl2与SO2 按物质的量之比1:1混合后,通入到品红溶液中,红色褪去 |
| D | 将CO2通入BaCl2溶液,出现白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
8.关于如图所示原电池的说法正确是 ( )


| A. | 锌电极是正电极 | B. | 锌电极得到电子 | ||
| C. | 铜电极上有氢气产生 | D. | 铜电极上发生氧化反应 |
1.CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO.生产流程如图:

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
(1)为提高碱溶速率,除适当增大NaOH溶液浓度、提高反应温度外,还可采取的措施有将废料研磨成更小颗粒.
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
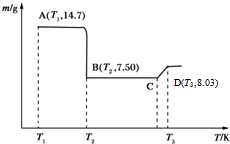
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.
