题目内容
9.下列离子方程式正确的是( )| A. | 硫酸铝溶液加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 稀盐酸与碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
分析 A.氨水碱性较弱,不能溶解氢氧化铝,氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
B.碳酸钙为沉淀,在离子反应中保留化学式;
C.醋酸为弱电解质应保留化学式;
D.稀硫酸中加入铁粉反应生成硫酸亚铁和氢气.
解答 解:A.AlCl3溶液中加入过量氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.碳酸钙中滴加盐酸的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.硅酸钠溶液与醋酸溶液混合:SiO32-+2CH3COOH=H2SiO3↓+2CH3COO-,故C错误;
D.将铁粉加入稀硫酸中的离子反应为Fe+2H+═Fe2++H2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列离子方程式书写正确的是( )
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO${\;}_{3}^{-}$+OH-+Ca2+═CaCO3↓+H2O | |
| C. | C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用惰性电极电解MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
17.以下有关物质结构的描述正确的是( )
| A. | 二氯甲烷分子为正四面体结构 | |
| B. | 2-丁烯分子中4个碳原子不在同一平面内 | |
| C. | 甲苯分子中7个碳原子都在同一平面内 | |
| D. | 丙烷分子中的3个碳原子一定在同一条直线上 |
4.下列物质属于纯净物的是( )
| A. | 水玻璃 | B. | 漂白粉 | C. | 液氨 | D. | 24K黄金 |
14.苹果汁是人们喜爱的饮料,由于含有Fe2+,现榨的苹果汁会由淡绿色变为棕黄色,在这种苹果汁中加入维生素C,可避免该现象,这些现象体现了( )
| A. | Fe2+具有氧化性,维生素C具有还原性 | |
| B. | Fe2+具有氧化性,维生素C也具有氧化性 | |
| C. | Fe2+具有还原性,维生素C具有氧化性 | |
| D. | Fe2+具有还原性,维生素C也具有还原性 |
1.下列说法中正确的是( )
| A. | 金属铜在物质分类中属于单质,所以它既不是电解质也不是非电解质 | |
| B. | 强电解质水溶液的导电性一定比弱电解质水溶液的导电性强 | |
| C. | 用硫化亚铁除去污水中的铜离子,是利用硫化亚铁比硫化铜在水中更难溶 | |
| D. | 对于已经达到平衡的化学反应,改变压强,平衡常数(K)可能改变 |
18.实验室里需储存在棕色试剂瓶中的是( )
| A. | 金属钠 | B. | 浓硝酸 | C. | FeSO4溶液 | D. | 浓硫酸 |
19.常温常压下.甲烷与足量的氧气共60mL.点燃充分反应后.恢复到常温常压,剩余气体体积为24mL,则原混合气体中含甲烷( )
| A. | 25mL | B. | 17mL | C. | 18mL | D. | 25mL |
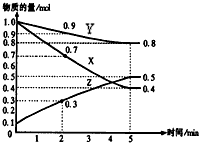 在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.