题目内容
【题目】党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4 和 HMCM-22 的表面,以 CO2 为碳源,与电解水产生的 H2 催化转化为高附加值的烃类化合物,其过程如图。
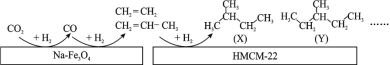
图中 CO2 转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJmol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJmol-1。图中 CO 转化为 C2H4 的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2 合成甲醇,其反应为:CO(g)+2H2(g)CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
该反应速率的通式为 v正=k正 cm(CO)cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______、n =_____(取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 molL-1时达到平衡,请计算该反应的平衡常数 K = _____。
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
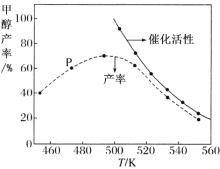
请判断温度为 470 K 时,图中 P 点 _________(填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____、 _____。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
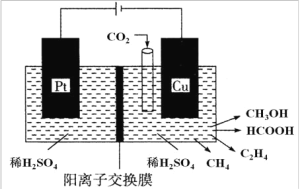
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________。
②如果Cu 电极上只生成 0.15 mol C2H4 和 0.30 mol CH3OH,则 Pt 电极上产生O2 的物质的量为 ___________mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 molL-1 HCOOH 溶液与 0.1 molL-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________(用含 a、b 的代数式表示)。
【答案】2CO(g) +4H2(g) = C2H4(g) + 2H2O(g) △H= - 210 kJ/mol 1 1 16 不是 升高温度,反应逆向移动 催化剂活性降低 CO2+6H++6e-= CH3OH+H2O 0.675 ![]()
【解析】
(1)根据盖斯定律计算;
(2)①将表格数据代入公式,利用待定系数法求解;通过三段式计算平衡常数;
②根据图示和影响反应速率因素作答;
(3)①铜电极为阴极,得电子发生还原反应;
②根据电路中电子守恒进行计算;
③HCOOH的电离常数K=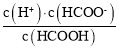 ,据此进行计算。
,据此进行计算。
(1)图中CO2转化为CO的反应为: CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol,已知:2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) △H= -128kJ/mol,将第二个方程式减去第一个方程式的2倍得到CO转化为C2H4的热化学方程式:2CO(g) +4H2(g) = C2H4(g) + 2H2O(g) △H= - 210 kJ/mol,故答案为:2CO(g) +4H2(g) = C2H4(g) + 2H2O(g) △H= - 210 kJ/mol;
(2) ①v正=k正 cm(CO)cn(H2)可知实验1中,0.391mol/(L·min)= k正×(0.25mol/L)m×(0.50mol/L)n;实验2中:0.781mol/(L·min)= k正×(0.25mol/L)m×(1.00mol/L)n;实验2中:0.780mol/(L·min)= k正×(0.50mol/L)m×(0.50mol/L)n;则2/1可得2=2n,即n=1;3/1得2=2m,则m=1;当实验 1 中 c(H2) = 0.25 mol·L-1时达到平衡,通过三段式计算有 ,平衡常数 K =
,平衡常数 K =![]() =16,故答案为:1;1;16;
=16,故答案为:1;1;16;
②温度为470K时,图中P点不是处于平衡状态;在490K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快,490K之后,甲醇产率下降的原因是升高温度,反应逆向移动、催化剂活性降低,故答案为:不是;升高温度,反应逆向移动;催化剂活性降低;
(3)①铜电极与电源负极相连为阴极,CO2得电子被还原生成CH3OH,根据电荷守恒元素守恒可知电极反应方程式为:CO2+6H++6e-= CH3OH+H2O,故答案为:CO2+6H++6e-= CH3OH+H2O;
②C2H4和CH3OH中碳均为-2价,CO2转化成C2H4和CH3OH化合价均降低6价,所以生成0.15molC2H4和0.30 molCH3OH时转移的电子为2.7mol,则生成的氧气为![]() =0.675mol,故答案为:0.675;
=0.675mol,故答案为:0.675;
③混合后溶液呈中性,所以c(H+)= c(OH-)=10-7mol/L,根据电荷可知c(HCOO-)=c(Na+)=![]() ,根据物料守恒有:c(HCOO-)+ c(HCOOH)=
,根据物料守恒有:c(HCOO-)+ c(HCOOH)= ![]() ,所以c(HCOOH)=
,所以c(HCOOH)= ![]() ,电离平衡常数Ka=
,电离平衡常数Ka=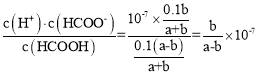 ,故答案为:
,故答案为:![]() 。
。

 优学名师名题系列答案
优学名师名题系列答案【题目】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___、___、___等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____;
b.实验编号3的实验中KClO3的分解率为____%(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___(填分子式),可用____试纸检验,上述异常现象产生的原因是____;
(5)实验结论:____。
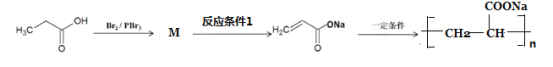
【题目】碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
![]()
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____(填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
序号 | 实验 | 操作 | 现象 |
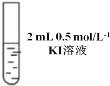
Ⅰ |
| 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
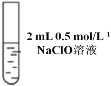
Ⅱ |
| 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2 在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因: __________(用离子方程式表示)。
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________。
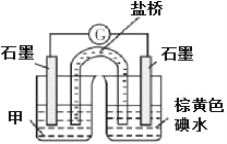
③小组同学又设计了如下实验:
序号 | 实验 | 操作 | 现象 |
Ⅳ |
| 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因 _____________。