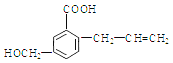题目内容
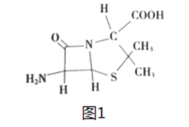
【题目】莲花清瘟对新型冠状病症状的改善有一定作用,其成分中含有“金银花”。中药“金银花”抗菌杀毒有效成分是“绿原酸”。以下是科研小组设计的“绿原酸”的合成路线:

回答下列问题:
(1)有机物A的名称是__________。
(2)反应①的反应类型是__________。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出有机物B的结构简式,用星号(*)标出B中的手性碳__________。
(4)反应D→E中第(1)步的反应方程式是__________。
(5)有机物F中官能团的名称是__________。
(6)反应②的目的是__________。
(7)有机物C的同分异构体有多种,满足以下条件的还有______种。(不考虑立体异构)
a. 具有六元碳环结构;
b. 含有3个氯原子,且同一碳原子上只能连接一个氯原子;
c. 能与NaHCO3溶液反应产生无色无味气泡。
(8)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线如图。
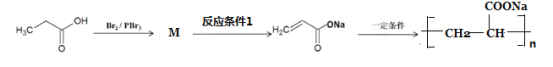
写出M结构简式__________;反应条件1为_______________。
【答案】1-氯-1,3-丁二烯 取代反应 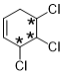
 +5NaOH
+5NaOH![]()
 +3NaCl+NaBr+H2O 酯基、羟基、醚键 保护其他羟基,防止其转化为酯基 11
+3NaCl+NaBr+H2O 酯基、羟基、醚键 保护其他羟基,防止其转化为酯基 11 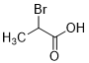 NaOH醇溶液加热
NaOH醇溶液加热
【解析】
由图可知,化合物A(![]() )与
)与![]() 发生双烯合成反应,生成B(
发生双烯合成反应,生成B(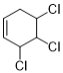 ),B与CO、H2O在Ni的催化下反应生成C(
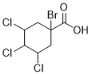
),B与CO、H2O在Ni的催化下反应生成C(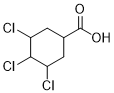 ),C与Br2发生取代反应生成D(
),C与Br2发生取代反应生成D(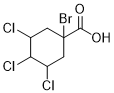 ),D发生水解得到E(
),D发生水解得到E(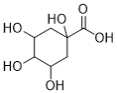 ),E与丙酮(
),E与丙酮(![]() )反应,保护四个羟基得到F(
)反应,保护四个羟基得到F(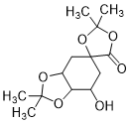 ),F与
),F与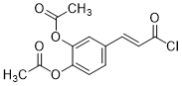 发生取代反应,再用H+将酯基和丙酮叉水解,得到
发生取代反应,再用H+将酯基和丙酮叉水解,得到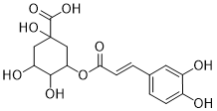 。
。
(1)有机物A(![]() )为1-氯-1,3-丁二烯;
)为1-氯-1,3-丁二烯;
(2)根据分析,反应①是Br原子取代了羧基的α-H,是取代反应;
(3)根据分析,B为 ,手性碳有3个,
,手性碳有3个, ;
;
(4)根据分析,反应D→E中第(1)步的反应方程式是 +5NaOH
+5NaOH![]()
 +3NaCl+NaBr+H2O;
+3NaCl+NaBr+H2O;
(5)有机物F( )中的官能团有酯基、羟基、醚键;
)中的官能团有酯基、羟基、醚键;
(6)反应②羟基与丙酮反应生成丙酮叉,后续反应又将丙酮叉水解,故作用是保护其他羟基,防止其转化为酯基;
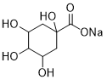
(7)能与NaHCO3溶液反应产生无色无味气泡说明C有羧基,满足条件的同分异构体有: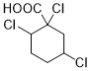 、
、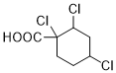 、
、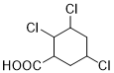 、
、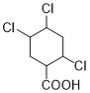 、
、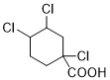 、
、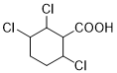 、
、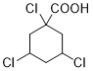 、
、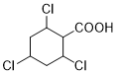 、
、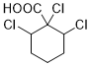 、
、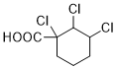 、
、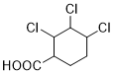 、
、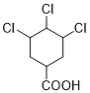 12种,除了C之外还有11种;
12种,除了C之外还有11种;
(8)Br原子应取代羧基的α-H,故M为 ;反应
;反应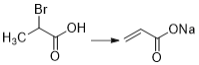 为卤代烃的消去反应,故条件为NaOH醇溶液加热;
为卤代烃的消去反应,故条件为NaOH醇溶液加热;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4 和 HMCM-22 的表面,以 CO2 为碳源,与电解水产生的 H2 催化转化为高附加值的烃类化合物,其过程如图。
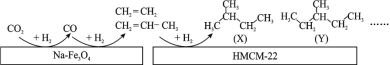
图中 CO2 转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJmol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJmol-1。图中 CO 转化为 C2H4 的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2 合成甲醇,其反应为:CO(g)+2H2(g)CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
该反应速率的通式为 v正=k正 cm(CO)cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______、n =_____(取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 molL-1时达到平衡,请计算该反应的平衡常数 K = _____。
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
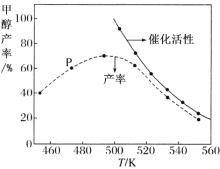
请判断温度为 470 K 时,图中 P 点 _________(填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____、 _____。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
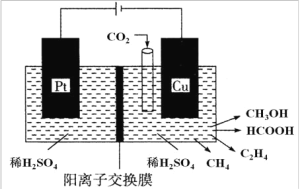
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________。
②如果Cu 电极上只生成 0.15 mol C2H4 和 0.30 mol CH3OH,则 Pt 电极上产生O2 的物质的量为 ___________mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 molL-1 HCOOH 溶液与 0.1 molL-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________(用含 a、b 的代数式表示)。