��Ŀ����
����Ŀ������������������Ԫ�أ����������������������Ҫ���á�����Ҫ�����ں���(�纣��)����ˮ���ο��С�ijС��ͬѧ�������ʵ������ģ��Ӻ�������ȡ�⡣
![]()
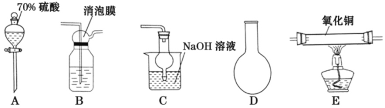
(1)���պ���ʱ������Ҫ���ż��⣬����Ҫ�õ�������������_____(������ĸ)��
A.�ձ� B.���� C.������ D.������ E.�ƾ��� F.�����
(2)�������� �ǹؼ����衣С��ͬѧ���ʵ��̽�� KI ��Һ��������Ӧ��ʵ���¼�����ʾ��
��� | ʵ�� | ���� | ���� |
�� |
| �ȼ� 0.5 mL 0.5 mol/L NaClO ��Һ����μ��ε�����Һ | ��Һ�ȱ�Ϊdz��ɫ����Һ���� |
�� |
| �ȼ� 0.5 mL 0.5 mol/L KI ��Һ��μ��ε�����Һ | ����Һ������ɫ����ҺҲ���������� pH=10 |
��ʵ�������Һ��Ϊdz��ɫ��������Ӧ�����ӷ���ʽ�ǣ�_________________ ��
�ڶԱ�ʵ�� I �� II��̽��ʵ�� II ��Ӧ������Һ����������ԭ��С��ͬѧ������ּ��裺
���� 1��NaClO ��Һ�Լ��ԣ�I2 �ڼ�����Һ�����绯��Ӧ 3I2 +6OH��= IO3��+ 5I��+ 3H2O��
���� 2��NaClO ��Һ��ǿ�����ԣ������� I2��
(a)NaClO ��Һ�Լ��Ե�ԭ�� __________(�����ӷ���ʽ��ʾ)��
(b)���ʵ�� III��֤ʵ���� 2 ����������װ����ͼ��ʾ������Һ��___________ ��ʵ��������______________��
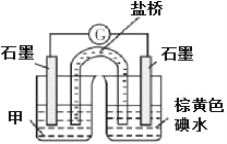
��С��ͬѧ�����������ʵ�飺
��� | ʵ�� | ���� | ���� |
�� |
| �����Թ� | 2 Сʱ��μӵ�����Һ�ų�����ɫ |
�� | �����Թ� ˮԡ 70�� | 20 min ��Һ������ɫ����ȴ�����º�μӵ�����Һ������ɫ | |
�� | �ܱ��Թ� ˮԡ 70�� | ��ҺѸ�ٳ��ֻ�ɫ���һ�ɫ�ӣ���ȴ�����º�μӵ�����Һ������ɫ |
(a)����ʵ��������͢����ó�Ӱ���������� KI ��Һ�ķ�Ӧ���ʵ������� ____��_____ ��
(b)�Խ�����ʵ�����ȣ�ʵ������ʽ�����ԭ�� _____________��
���𰸡�BDE 2I-+ ClO-+H2O= I2+ Cl-+ 2OH- ClO-+H2O![]() HClO+OH- ����������Һ �Ҳ��ˮ��ɫ��dz��������ָ�뷢��ƫת �¶� �Թܿ��շ�ʽ ���ڷ�ʽ�����¶�Ϊ70�棬�����ĵⵥ�����ӷ�����ȴ����������ⵥ�ʣ��ʷ�Ӧ����
HClO+OH- ����������Һ �Ҳ��ˮ��ɫ��dz��������ָ�뷢��ƫת �¶� �Թܿ��շ�ʽ ���ڷ�ʽ�����¶�Ϊ70�棬�����ĵⵥ�����ӷ�����ȴ����������ⵥ�ʣ��ʷ�Ӧ����
��������
(1)�������ղ����������𣻣�
(2)�ٴ������ƾ���ǿ�����ԣ��ɽ�I-�����ɵ��ʵ⣬��ˮ��dz��ɫ��
��(a)��������������ǿ���Σ���ˮ����Լ��ԣ�
(b)����ԭ���ԭ���������ã�
��(a)���ݱ��Ա�����
(b)�¶�Ϊ70�棬�����ĵⵥ�����ӷ�����ȴ����������ⵥ�ʡ�
(1)���պ������ʱ����Ҫ�õ����żܡ��ƾ��ơ�ʢ�ź���������Լ�֧�������������ǣ��ʴ�Ϊ��BDE��
(2)��ʵ��I�з�����Ӧ2I-+ ClO-+H2O= I2+ Cl-+ 2OH-���õ����ʵ⣬��ˮ��dz��ɫ���ʴ�Ϊ��2I-+ ClO-+H2O= I2+ Cl-+ 2OH-��
��(a)���������ˮ�л�ˮ�⣺ClO-+H2O![]() HClO+OH-������Լ��ԣ��ʴ�Ϊ��ClO-+H2O
HClO+OH-������Լ��ԣ��ʴ�Ϊ��ClO-+H2O![]() HClO+OH-��
HClO+OH-��
(b)��ȻҪ��֤���������ܷ��������ʵ⣬����ҺӦ�Ǵ���������Һ���������ܷ���������ԭ��Ӧ���Ҳ��ˮ�����Ķ���ɫ��dz�����ҵ�������ָ��ᷢ��ƫת ���ʴ�Ϊ������������Һ���Ҳ��ˮ��ɫ��dz��������ָ�뷢��ƫת��
��(a)���ݱ��ó�Ӱ���������� KI ��Һ�ķ�Ӧ���ʵ��������¶ȡ��Թܿ��շ�ʽ���ʴ�Ϊ���¶ȣ��Թܿ��շ�ʽ��
(b)���� ���Աȣ������ó��ڷ�ʽ�����¶�Ϊ70�棬�����ĵⵥ�����ӷ�����ȴ����������ⵥ�ʣ��ʷ�Ӧ�������ʴ�Ϊ�����ڷ�ʽ�����¶�Ϊ70�棬�����ĵⵥ�����ӷ�����ȴ����������ⵥ�ʣ��ʷ�Ӧ������

 ������ϵ�д�
������ϵ�д�����Ŀ������ʮ�Ŵ��ж���ἰ����ɫ������������̬���������� CO2 ����Ч���ÿ��Ի�������ЧӦ�������Դ��ȱ���⡣
(1)ij�о����Ŀ�����Ա���������״��� Na��Fe3O4 �� HMCM��22 �ı��棬�� CO2 Ϊ̼Դ������ˮ������ H2 ��ת��Ϊ�߸���ֵ���������������ͼ��
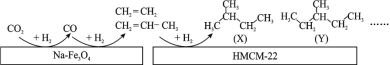
ͼ�� CO2 ת��Ϊ CO �ķ�ӦΪ��CO2(g) + H2(g)=CO(g) + H2O(g) ��H1 = + 41 kJmol-1����֪��2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ��H2=��128 kJmol-1��ͼ�� CO ת��Ϊ C2H4 ���Ȼ�ѧ����ʽ��__________________ ��
(2)�״���δ����Ҫ����ɫ��Դ֮һ���ڹ�ҵ�г��� CO��H2 �ϳɼ״����䷴ӦΪ��CO(g)+2H2(g)CH3OH(g) ��H3 < 0
��Ϊ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬200�� ʱ�� 10 L �����ܱ������н���ʵ�飬��õ�ʵ���������±���ʾ��
ʵ�� | ��ʼŨ��/(mol��L-1) | ��ʼ����/(mol��L-1��min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
�÷�Ӧ���ʵ�ͨʽΪ v��=k�� cm(CO)cn(H2)(k �������¶��йص����ʳ���)���ɱ������ݿ�ȷ����Ӧ����ͨʽ�� m =_______��n =_____(ȡ������)��ʵ�鷢�֣���ʵ�� 1 �� c(H2) = 0.25 molL��1ʱ�ﵽƽ�⣬�����÷�Ӧ��ƽ�ⳣ�� K = _____��
������һ�������� CO �� H2 ��װ�д����ķ�Ӧ���з�Ӧ 12 Сʱ����ϵ�м״��IJ��ʺʹ����Ĵ��������¶ȵĹ�ϵ��ͼ��ʾ��
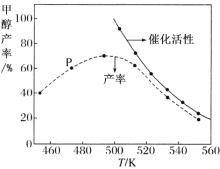
���ж��¶�Ϊ 470 K ʱ��ͼ�� P �� _________(������������������)����ƽ��״̬��490 K ֮�״��������¶����߶���С�Ŀ���ԭ��Ϊ��_____�� _____��
(3)�����������о���Ա�� CO2 ͨ��������ɶ���ȼ�ϣ��乤��ԭ����ͼ��ʾ��
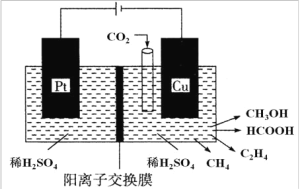
����д�� Cu �缫�ϲ��� CH3OH �ĵ缫��Ӧʽ��_____________��
�����Cu �缫��ֻ���� 0.15 mol C2H4 �� 0.30 mol CH3OH���� Pt �缫�ϲ���O2 �����ʵ���Ϊ ___________mol��
����֪ HCOOH ΪһԪ���ᣬ�����½� 0.1 molL��1 HCOOH ��Һ�� 0.1 molL��1 NaOH ��Һ������� a : b���(������Һ����ı仯)����Ϻ���Һǡ�������ԣ��� HCOOH �ĵ��볣�� Ka=_____________(�ú� a��b �Ĵ���ʽ��ʾ)��
����Ŀ��ij�¶��£���ӦH2(g)+CO2(g)![]() H2O(g)+CO(g)��ƽ�ⳣ��K=
H2O(g)+CO(g)��ƽ�ⳣ��K=![]() �����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�� | �� | �� | |
c(H2)/(mol��L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol��L-1) | 0.010 | 0.010 | 0.020 |
�����жϲ���ȷ����( )
A. ��Ӧ��ʼʱ���������л�ѧ��Ӧ������������л�ѧ��Ӧ������С
B. ƽ��ʱ����������CO2��ת���ʴ���60%
C. ƽ��ʱ���������кͱ�������H2��ת���ʾ���60%
D. ƽ��ʱ����������c(CO2)�Ǽ������е�2������ 0.012 mol��L-1